
Newsletter Subscribe
Enter your email address below and subscribe to our newsletter

Zverejnené: 12. januára 2018 mRNA vakcíny – nová éra vo vakcinológii
Myslím si, že vôbec nie je potrebné komentovať. Následne odosielam tieto veci pre SAV, ŠÚKL, ministerstvu zdravotníctva SR, predsedovi vlády SR, prezidentovi SR, Dankovi, poslancom NR SR, Europoslancom SR, mimoparlamentným stranám, aby sa pozreli na seba do zrkadla a prestali klamať, že o ničom nevedeli !! Podviedli ľudí a všetci !! Keďže EMA sama priznáva o týchto klinických štúdiách, a každý jeden štátny úrad o tom vedel ako je SAV, ŠÚKL, imunológia, infektológia , politici, výbory NR SR, Europoslanci a atď atď. To, čo dnes vyvádzajú Fico s Kotlárom, je len fraška, divadlo . Sú to klamári, ako pri MZP a Pandemickej zmluve !! Copyright© O.z. Dôstojnosť Slovenska
Odporúčam každému to aj čítať, pretože následne boli prijaté niektoré zákony pre uvedenie týchto vakcín a hromadné klinické štúdie počas nedávneho očkovania, nežiadúce účinky a atď, vojenská organizácia BARDA a podobne !! Vedeli o všetkom, preto nebojovali za ľudí, ale podlo vo všetkom klamali, hlasovali ZA a vo všetkých zákonoch a to doslovne všetci !!
Pritom v roku 2017 bolo zriadené: Panely odborníkov na zdravotnícke pomôcky, kde tieto panely následne a urýchlene schválili mRNA vakcíny.
V Európskej únii (EÚ) poskytujú odborné panely zdravotníckych pomôcok vstupné informácie o klinickom hodnotení a hodnotení výkonu určitých vysokorizikových zdravotníckych pomôcok a diagnostických zdravotníckych pomôcok in vitro na účely posudzovania zhody. Pomáha to zaistiť bezpečnosť a výkonnosť zdravotníckych pomôcok na trhu EÚ a uľahčuje ich včasnú dostupnosť pre pacientov.
Panely odborníkov boli zriadené podľa týchto nariadení:
Európska komisia vymenúva členov panelov odborníkov po konzultácii s Koordinačnou skupinou pre zdravotnícke pomôcky (MDCG) na základe ich vedeckých, klinických a technických odborných znalostí.
Vedie zoznam oprávnených odborníkov, ktorí nie sú vymenovaní do poroty. V prípade potreby možno týchto odborníkov požiadať, aby podporili prácu skupiny odborníkov.
Životopisy odborníkov a vyhlásenia o záujme (DoI) sú k dispozícii na webovej stránke Európskej komisie .
Viac informácií o tom, ako sa pripojiť k panelu odborníkov, nájdete nižšie.
Existuje dvanásť odborných panelov.
Skríningová komisia určí, či je potrebný názor odbornej komisie.
Existuje jedenásť tematických panelov:
Koordinačný výbor zložený z predsedov a podpredsedov odborných panelov umožňuje výmenu informácií a zachováva spoločné štandardy a postupy.
Nariadenie (EÚ) 2017/746, Nariadenie (EÚ) 2017/745
Pracovné pokyny pre notifikované osoby o uplatňovaní článku 54 nariadenia (EÚ) 2017/745 o zdravotníckych pomôckach a článku 48 nariadenia (EÚ) 2017/746 o diagnostických zdravotníckych pomôckach in vitro Referenčné číslo: EMA/416077/2023
Angličtina (EN) (2,29 MB – PDF) Zobraziť Zdroj
Všetko o schválených vakcínach, klinické skúšky, mRNA, saRNA tu a tu
mRNA vakcíny predstavujú sľubnú alternatívu ku konvenčným vakcínovým prístupom kvôli ich vysokej účinnosti, schopnosti rýchleho vývoja a potenciálu pre nízkonákladovú výrobu a bezpečné podávanie. Avšak ich aplikácia bola donedávna obmedzená nestabilitou a neefektívnym in vivo dodaním mRNA. Nedávne technologické pokroky teraz do značnej miery prekonali tieto problémy a viaceré platformy vakcín mRNA proti infekčným chorobám a niekoľkým typom rakoviny preukázali povzbudivé výsledky na zvieracích modeloch aj na ľuďoch. Tento prehľad poskytuje podrobný prehľad mRNA vakcín a zvažuje budúce smerovanie a výzvy pri rozširovaní tejto sľubnej vakcínovej platformy na široké terapeutické využitie.
Vakcíny zabránia mnohým miliónom chorôb a zachránia každý rok množstvo životov 1 . V dôsledku rozsiahleho používania vakcín bol vírus pravých kiahní úplne vyhubený a výskyt detskej obrny, osýpok a iných detských chorôb sa na celom svete drasticky znížil 2 . Konvenčné vakcínové prístupy, ako sú živé oslabené a inaktivované patogény a podjednotkové vakcíny, poskytujú trvalú ochranu proti rôznym nebezpečným chorobám 3 . Napriek tomuto úspechu stále existujú veľké prekážky vo vývoji vakcín proti rôznym infekčným patogénom, najmä tým, ktoré sú schopné lepšie sa vyhnúť adaptívnej imunitnej odpovedi 4 . Okrem toho pre väčšinu nových vírusových vakcín nie je hlavnou prekážkou účinnosť konvenčných prístupov, ale potreba rýchlejšieho vývoja a rozsiahleho nasadenia. Nakoniec, konvenčné vakcínové prístupy nemusia byť aplikovateľné na neinfekčné ochorenia, ako je rakovina. Preto je naliehavo potrebný vývoj silnejších a všestrannejších očkovacích platforiem. Copyright© O.z. Dôstojnosť Slovenska
Nukleokyselinové terapeutiká sa ukázali ako sľubné alternatívy ku konvenčným vakcínovým prístupom. Prvá správa o úspešnom použití in vitro transkribovanej (IVT) mRNA u zvierat bola publikovaná v roku 1990, keď boli myšiam injikované mRNA reportérového génu a bola zistená produkcia proteínov 5 . Následná štúdia v roku 1992 preukázala, že podanie mRNA kódujúcej vazopresín do hypotalamu môže vyvolať fyziologickú odpoveď u potkanov 6 . Tieto skoré sľubné výsledky však neviedli k podstatným investíciám do vývoja mRNA terapeutík, najmä kvôli obavám spojeným s nestabilitou mRNA, vysokou vrodenou imunogenicitou a neefektívnym in vivo dodaním. Namiesto toho sa v tejto oblasti uplatňovali terapeutické prístupy založené na DNA a proteínoch 7 , 8 .
Za posledné desaťročie veľké technologické inovácie a investície do výskumu umožnili, aby sa mRNA stala sľubným terapeutickým nástrojom v oblasti vývoja vakcín a proteínovej substitučnej terapie. Použitie mRNA má niekoľko výhodných vlastností oproti podjednotkovým, usmrteným a živým oslabeným vírusom, ako aj vakcínam na báze DNA. Po prvé, bezpečnosť: keďže mRNA je neinfekčná, neintegrujúca sa platforma, neexistuje žiadne potenciálne riziko infekcie alebo inzerčnej mutagenézy. Okrem toho je mRNA degradovaná normálnymi bunkovými procesmi a jej polčas rozpadu in vivo možno regulovať použitím rôznych modifikácií a spôsobov podávania9,10,11,12 . Inherentná imunogenicita mRNA môže byť znížená, aby sa ďalej zvýšil bezpečnostný profil9,12,13 . Po druhé, účinnosť: rôzne modifikácie robia mRNA stabilnejšou a vysoko translatovateľnou 9 , 12 , 13 . Efektívne dodanie in vivo možno dosiahnuť formulovaním mRNA do molekúl nosiča, čo umožňuje rýchle vychytávanie a expresiu v cytoplazme (prehľad v odkazoch 10 , 11 ). mRNA je minimálny genetický vektor; preto sa predchádza antivektorovej imunite a mRNA vakcíny sa môžu podávať opakovane. Po tretie, výroba: mRNA vakcíny majú potenciál na rýchlu, nenákladnú a škálovateľnú výrobu, najmä vďaka vysokým výťažkom transkripčných reakcií in vitro .
Oblasť mRNA vakcín sa vyvíja extrémne rýchlo; za posledných niekoľko rokov sa nazhromaždilo veľké množstvo predklinických údajov a začali sa viaceré klinické štúdie na ľuďoch. V tomto prehľade diskutujeme o súčasných prístupoch k vakcínam mRNA, sumarizujeme najnovšie zistenia, upozorňujeme na výzvy a nedávne úspechy a ponúkame pohľady na budúcnosť vakcín mRNA. Údaje naznačujú, že mRNA vakcíny majú potenciál vyriešiť mnohé výzvy vo vývoji vakcín proti infekčným chorobám aj rakovine.
mRNA je medzistupňom medzi transláciou DNA kódujúcej proteín a produkciou proteínov ribozómami v cytoplazme. Ako vakcíny sa v súčasnosti študujú dva hlavné typy RNA: nereplikujúca sa mRNA a vírusovo odvodená, samoamplifikujúca sa RNA. Bežné vakcíny na báze mRNA kódujú požadovaný antigén a obsahujú 5′ a 3′ nepreložené oblasti (UTR), zatiaľ čo samoamplifikujúce sa RNA kódujú nielen antigén, ale aj vírusový replikačný mechanizmus, ktorý umožňuje intracelulárnu amplifikáciu RNA a hojnú expresiu proteínov. Copyright© O.z. Dôstojnosť Slovenska
Konštrukcia optimálne preloženej IVT mRNA vhodnej na terapeutické použitie bola preskúmaná skôr14,15 . V stručnosti, IVT mRNA je produkovaná z lineárneho DNA templátu pomocou T7, T3 alebo Sp6 fágovej RNA polymerázy16 . Výsledný produkt by mal optimálne obsahovať otvorený čítací rámec, ktorý kóduje požadovaný proteín, lemujúce UTR, 5′ uzáver a poly(A) chvost. mRNA je teda skonštruovaná tak, aby sa podobala úplne spracovaným zrelým molekulám mRNA, ako sa prirodzene vyskytujú v cytoplazme eukaryotických buniek.
Komplexovanie mRNA na dodávanie in vivo bolo tiež nedávno podrobne opísané10,11 . Nahá mRNA je rýchlo degradovaná extracelulárnymi RNázami 17 a nie je účinne internalizovaná. Bolo teda vyvinuté veľké množstvo in vitro a in vivo transfekčných činidiel, ktoré uľahčujú bunkový príjem mRNA a chránia ju pred degradáciou. Akonáhle mRNA prejde do cytosolu, bunkový translačný aparát produkuje proteín, ktorý podlieha posttranslačným modifikáciám, čo vedie k správne poskladanému, plne funkčnému proteínu. Táto vlastnosť mRNA farmakológie je obzvlášť výhodná pre vakcíny a proteínové substitučné terapie, ktoré vyžadujú, aby boli cytosolické alebo transmembránové proteíny dodané do správnych bunkových kompartmentov pre správnu prezentáciu alebo funkciu. IVT mRNA je nakoniec degradovaná normálnymi fyziologickými procesmi, čím sa znižuje riziko toxicity metabolitov.
V posledných rokoch boli vyvinuté rôzne mRNA vakcínové platformy a overené v štúdiách imunogenicity a účinnosti18 , 19 , 20 . Vďaka inžinierstvu RNA sekvencie je syntetická mRNA preložiteľnejšia ako kedykoľvek predtým. Boli vyvinuté vysoko účinné a netoxické nosiče RNA, ktoré v niektorých prípadoch21,22 umožňujú predĺženú expresiu antigénu in vivo ( tabuľka 1 ) . Niektoré formulácie vakcín obsahujú nové adjuvans, zatiaľ čo iné vyvolávajú silné reakcie v neprítomnosti známych adjuvans. Nasledujúca časť sumarizuje kľúčové pokroky v týchto oblastiach inžinierstva mRNA a ich vplyv na účinnosť vakcíny.
Tabuľka 1 Stratégie komplexovania mRNA vakcíny na použitie in vivo
Typ doručovacieho systému Cesta doručenia Druhy Cieľ Komerčné transfekčné činidlo v Myška OVA 145 Protamín id Myš, fretka, prasa a človek Vírus chrípky 18 , 52 , melanóm 150 , nemalobunkový karcinóm pľúc 200 , rakovina prostaty 36 , 52 , 151 , vírus besnoty 56 , OVA 36 , 52 , 155 a Lewisova rakovina pľúc 155 Protamínový lipozóm iv Myška Rakovina pľúc 201 Polysacharidová častica sc Myš a králik Vírus chrípky 98 Katiónová nanoemulzia im Myš, králik, fretka a makak rhesus Vírus chrípky 96 , RSV50 , HIV-1 (odkazy 50 , 97 ), HCMV50 , Streptococcus spp . 100 , HCV a vírus besnoty 87 Katiónový polymér sc a in Myška Vírus chrípky 99 a HIV-1 (odkazy 110 , 111 ) Lipozóm katiónového polyméru iv Myška Melanóm 202 , 203 , rakovina pankreasu 204 Katiónové lipidové nanočastice id, iv a sc Myška HIV-1 (odkaz 109 ) a OVA 152 Katiónový lipid, nanočastice cholesterolu iv, sc a is Myška Vírus chrípky 59 , 108 , melanóm 59 , 141 , Moloneyho vírus myšej leukémie, OVA, HPV a pod. rakovina 59 Katiónový lipid, cholesterol, PEG nanočastice id, im a sc Myš, bavlník a makak rhesus Vírus Zika 20 , 85 , 112 , vírus chrípky 22 , 94 , 95 , 205 , RSV 19 , HCMV, vírus besnoty 87 a melanóm 153 Nanočastice dendriméru im Myška Vírus chrípky, vírus Ebola, Toxoplasma gondii 89 a vírus Zika 88
- HCMV, ľudský cytomegalovírus; HCV, vírus hepatitídy C; HPV, ľudský papilomavírus; id, intradermálne; im, intramuskulárne; intranazálne; je intrasplenický; iv, intravenózne; OVA, modely rakoviny exprimujúce ovalbumín; PEG, polyetylénglykol; RSV, respiračný syncyciálny vírus; sc, subkutánne.
Táto téma bola obšírne diskutovaná v predchádzajúcich recenziách 14 , 15 ; preto stručne zhrnieme kľúčové zistenia ( rámček 1 ). Elementy 5′ a 3′ UTR lemujúce kódujúcu sekvenciu výrazne ovplyvňujú stabilitu a transláciu mRNA, pričom obe sú kritickým problémom vakcín. Tieto regulačné sekvencie môžu byť odvodené z vírusových alebo eukaryotických génov a výrazne zvyšujú polčas a expresiu terapeutických mRNA23,24 . Na efektívnu produkciu proteínu z mRNA25 je potrebná 5′ čiapočková štruktúra . Rôzne verzie 5′ uzáverov môžu byť pridané počas alebo po transkripčnej reakcii s použitím krycieho enzýmu 26 vírusu vakcínie alebo začlenením syntetického uzáveru alebo analógov 27 , 28 s antireverzným uzáverom . Poly(A) chvost tiež hrá dôležitú regulačnú úlohu pri translácii a stabilite mRNA25 ; teda optimálna dĺžka poly(A) 24 musí byť pridaná k mRNA buď priamo z kódujúceho DNA templátu alebo pomocou poly(A) polymerázy. Použitie kodónov má navyše vplyv na transláciu proteínu. Nahradenie vzácnych kodónov často používanými synonymnými kodónmi, ktoré majú v cytosóle dostatok príbuznej tRNA, je bežnou praxou na zvýšenie produkcie proteínu z mRNA29 , hoci presnosť tohto modelu bola spochybňovaná30 . Obohatenie obsahu G:C predstavuje ďalšiu formu optimalizácie sekvencie, o ktorej sa ukázalo, že zvyšuje hladiny mRNA v ustálenom stave in vitro31 a expresiu proteínu in vivo12 .
Hoci expresia proteínu môže byť pozitívne modulovaná zmenou zloženia kodónov alebo zavedením modifikovaných nukleozidov (diskutované nižšie), je tiež možné, že tieto formy sekvenčného inžinierstva by mohli ovplyvniť sekundárnu štruktúru mRNA32 , kinetiku a presnosť translácie a simultánneho skladania proteínov33,34 a expresiu kryptických epitopov T buniek prítomných v čítacích rámcoch30 . Všetky tieto faktory by mohli potenciálne ovplyvniť veľkosť alebo špecifickosť imunitnej odpovede.
Na zlepšenie farmakologických aspektov mRNA sa v súčasnosti používa množstvo technológií. Rôzne použité modifikácie mRNA a ich vplyv sú zhrnuté nižšie.
• Syntetické cap analógy a capping enzýmy 26 , 27 stabilizujú mRNA a zvyšujú proteínovú transláciu väzbou na eukaryotický translačný iniciačný faktor 4E (EIF4E)
• Regulačné prvky v 5′-netranslatovanej oblasti (UTR) a 3′-UTR 23 stabilizujú mRNA a zvyšujú transláciu proteínov
• Poly(A) chvost 25 stabilizuje mRNA a zvyšuje transláciu proteínov
• Modifikované nukleozidy 9 , 48 znižujú prirodzenú imunitnú aktiváciu a zvyšujú transláciu
• Separačné a/alebo purifikačné techniky: ošetrenie RNázou III (NP a DW, nepublikované pozorovania) a purifikácia rýchlou proteínovou kvapalinovou chromatografiou (FPLC) 13 znižujú imunitnú aktiváciu a zvyšujú transláciu
• Optimalizácia sekvencie a/alebo kodónu 29 zvyšuje transláciu
• Modulácia cieľových buniek: spoločné dodávanie faktorov iniciácie translácie a iných metód mení transláciu a imunogenicitu
Exogénna mRNA je inherentne imunostimulačná, pretože ju rozpoznávajú rôzne bunkové povrchové, endozomálne a cytosolické vrodené imunitné receptory ( obr. 1 ) (zhrnuté v odkaze 35 ). V závislosti od terapeutickej aplikácie môže byť táto vlastnosť mRNA prospešná alebo škodlivá. Je potenciálne výhodná pre vakcináciu, pretože v niektorých prípadoch môže poskytnúť adjuvantnú aktivitu na riadenie dozrievania dendritických buniek (DC), a tak vyvolať silné imunitné reakcie T a B buniek. Avšak vrodené imunitné snímanie mRNA je tiež spojené s inhibíciou expresie antigénu a môže negatívne ovplyvniť imunitnú odpoveď9,13 . Hoci paradoxné účinky vrodeného imunitného snímania na rôzne formáty mRNA vakcín nie sú úplne pochopené, v posledných rokoch sa dosiahol určitý pokrok v objasňovaní týchto javov.
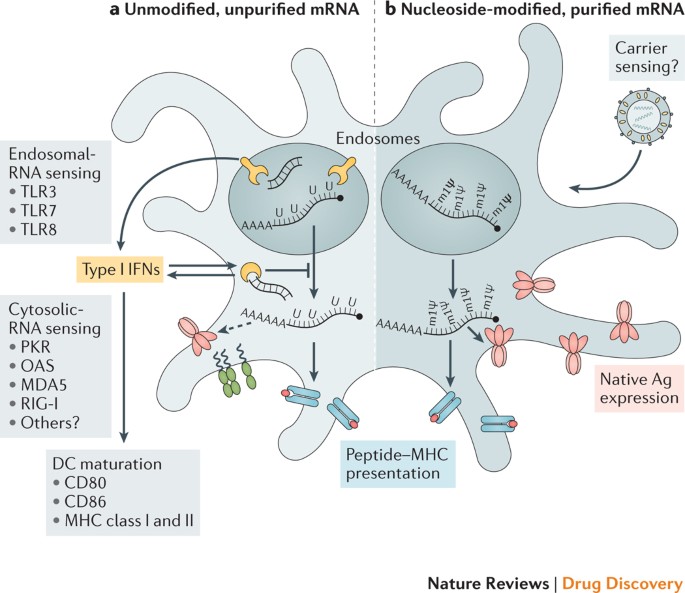
Vrodené imunitné snímanie dvoch typov mRNA vakcíny dendritickou bunkou (DC), pričom RNA senzory sú znázornené žltou farbou, antigén červenou farbou, faktory dozrievania DC zelenou farbou a komplexy peptid-hlavný histokompatibilný komplex (MHC) svetlomodrou a červenou farbou; príklad lipidového nanočasticového nosiča je zobrazený vpravo hore. Je zobrazený neúplný zoznam hlavných známych RNA senzorov, ktoré prispievajú k rozpoznávaniu dvojvláknových a nemodifikovaných jednovláknových RNA. Nemodifikované, nepurifikované (časť
a ) a nukleozidmi modifikované, rýchlou proteínovou kvapalinovou chromatografiou (FPLC) purifikované (časť
b ) mRNA boli vybrané na ilustráciu dvoch formátov mRNA vakcín, kde sú prítomné a neprítomné známe formy snímania mRNA. Prerušovaná šípka predstavuje zníženú expresiu antigénu. Ag, antigén; PKR, interferónom indukovaná, dvojvláknová RNA-aktivovaná proteínkináza; MDA5, interferónom indukovaný proteín 1 obsahujúci doménu helikázy C (tiež známy ako IFIH1); IFN, interferón; mlΨ, 1-metylpseudouridín; OAS, 2′-5′-oligoadenylátsyntetáza; TLR, Toll-like receptor.
Obrázok v plnej veľkosti PowerPointová snímka
Štúdie za posledné desaťročie ukázali, že imunostimulačný profil mRNA môže byť formovaný čistením IVT mRNA a zavedením modifikovaných nukleozidov, ako aj komplexovaním mRNA s rôznymi nosnými molekulami 9 , 13 , 36 , 37 . Enzymaticky syntetizované prípravky mRNA obsahujú kontaminanty dvojvláknovej RNA (dsRNA) ako aberantné produkty IVT reakcie13 . Ako napodobenina vírusových genómov a replikačných medziproduktov je dsRNA silný molekulárny vzor spojený s patogénom (PAMP), ktorý je snímaný receptormi rozpoznávania vzorov vo viacerých bunkových kompartmentoch ( obr. 1 ). Rozpoznanie IVT mRNA kontaminovanej dsRNA má za následok robustnú produkciu interferónu typu I13 , ktorý upreguluje expresiu a aktiváciu proteínkinázy R (PKR; tiež známej ako EIF2AK2) a 2′-5′-oligoadenylátsyntetázy (OAS), čo vedie k inhibícii translácie RNAm a riboscelulárnej RNA39 inhibujúcej transláciu39 . , resp. Karikó a kolegovia 13 preukázali, že kontaminujúca dsRNA môže byť účinne odstránená z IVT mRNA chromatografickými metódami, ako je rýchla proteínová kvapalinová chromatografia s reverznou fázou (FPLC) alebo vysokoúčinná kvapalinová chromatografia (HPLC). Prekvapivo sa ukázalo, že purifikácia pomocou FPLC zvyšuje produkciu proteínu z IVT mRNA až 1000-násobne v primárnych ľudských DC13 . Zdá sa teda, že vhodná purifikácia IVT mRNA je rozhodujúca pre maximalizáciu produkcie proteínu (imunogénu) v DC a pre zabránenie nežiaducej aktivácii vrodenej imunity.
Okrem kontaminantov dsRNA sú molekuly jednovláknovej mRNA samotné PAMP, keď sú exogénne dodávané do buniek. Jednovláknové oligoribonukleotidy a ich degradačné produkty sú detegované endozomálnymi senzormi Toll-like receptor 7 (TLR7) a TLR8 (Refs 40 , 41 ), čo vedie k produkcii interferónu typu I42 . Rozhodujúce je, že sa zistilo, že inkorporácia prirodzene sa vyskytujúcich chemicky modifikovaných nukleozidov, vrátane, ale nie výlučne, pseudouridínu 9 , 43 , 44 a 1-metylpseudouridínu 45 , zabraňuje aktivácii TLR7, TLR8 a iných vrodených imunitných senzorov 46 , 47 , čím sa redukuje signál interferónu typu I8 . Nukleozidová modifikácia tiež čiastočne potláča rozpoznávanie druhov dsRNA46,47,48 . V dôsledku toho Karikó a iní ukázali, že nukleozidmi modifikovaná mRNA sa in vitro 9 prekladá efektívnejšie ako nemodifikovaná mRNA , najmä v primárnych DC a in vivo u myší 45 . Je pozoruhodné, že najvyššia úroveň produkcie proteínov v DC bola pozorovaná, keď bola mRNA purifikovaná FPLC aj modifikovaná nukleozidmi13 . Tieto pokroky v porozumení zdrojov vrodeného imunitného snímania a spôsobu, ako sa vyhnúť ich nepriaznivým účinkom, podstatne prispeli k súčasnému záujmu o vakcíny na báze mRNA a terapiu náhrady proteínov.
Na rozdiel od zistení opísaných vyššie, štúdia Thessa a kolegov zistila, že sekvenčne optimalizovaná, HPLC purifikovaná, nemodifikovaná mRNA produkovala vyššie hladiny proteínu v HeLa bunkách a u myší ako jej nukleozidmi modifikovaný náprotivok 12 . Okrem toho Kauffman a spolupracovníci preukázali, že nemodifikovaná mRNA nečistená pomocou HPLC poskytla robustnejšiu produkciu proteínov v bunkách HeLa ako mRNA modifikovaná nukleozidmi a viedla k podobným úrovniam produkcie proteínov u myší 49 . Aj keď to nie je úplne jasné, nezrovnalosti medzi zisteniami Karikó 9 , 13 a týmito autormi 12 , 49 mohli vzniknúť v dôsledku variácií v optimalizácii sekvencie RNA, prísnosti purifikácie mRNA na odstránenie kontaminantov dsRNA a úrovne vrodeného imunitného snímania v cieľových typoch buniek.
Imunostimulačné vlastnosti mRNA možno naopak zvýšiť zahrnutím adjuvans na zvýšenie účinnosti niektorých formátov vakcín mRNA. Patria sem tradičné adjuvans, ako aj nové prístupy, ktoré využívajú vnútornú imunogenicitu mRNA alebo jej schopnosť kódovať imunomodulačné proteíny. Samoreplikujúce sa RNA vakcíny preukázali zvýšenú imunogenicitu a účinnosť po formulácii RNA v katiónovej nanoemulzii založenej na licencovanom adjuvans MF59 (Novartis) 50 . Ďalšou účinnou adjuvantnou stratégiou je TriMix, kombinácia mRNA kódujúcich tri imunitné aktivačné proteíny: CD70, CD40 ligand (CD40L) a konštitutívne aktívny TLR4. TriMix mRNA zosilnila imunogenicitu nahej, nemodifikovanej, nepurifikovanej mRNA vo viacerých štúdiách vakcín proti rakovine a bola spojená najmä so zvýšenou maturáciou DC a odpoveďami cytotoxických T lymfocytov (CTL) (prehľad v odkaze 51 ). Ukázalo sa tiež, že typ nosiča mRNA a veľkosť komplexu mRNA-nosič modulujú cytokínový profil indukovaný dodaním mRNA. Napríklad vakcinačná platforma RNActive (CureVac AG) 52 , 53 závisí od svojho nosiča, aby poskytoval adjuvantnú aktivitu. V tomto prípade je antigén exprimovaný z nahej, nemodifikovanej, sekvenčne optimalizovanej mRNA, zatiaľ čo adjuvantnú aktivitu poskytuje spoločne dodaná RNA v komplexe s protamínom (polykatiónový peptid), ktorý pôsobí prostredníctvom signalizácie TLR752,54 . Tento formát vakcíny vyvolal priaznivé imunitné reakcie vo viacerých predklinických štúdiách na zvieratách na očkovanie proti rakovine a infekčným chorobám 18 , 36 , 55 , 56 . Nedávna štúdia poskytla mechanické informácie o adjuvancii vakcín RNActive u myší in vivo a ľudských buniek in vitro54 . Po intradermálnej imunizácii bola preukázaná silná aktivácia TLR7 (myš a človek) a TLR8 (človek) a produkcia interferónu typu I, prozápalových cytokínov a chemokínov54 . Podobná adjuvantná aktivita bola tiež preukázaná v kontexte vakcín nezaložených na mRNA s použitím RNAdjuvantu (CureVac AG), nemodifikovanej, jednovláknovej RNA stabilizovanej katiónovým nosným peptidom57 .
Účinné dodávanie mRNA in vivo je rozhodujúce pre dosiahnutie terapeutickej relevancie. Exogénna mRNA musí preniknúť cez bariéru lipidovej membrány, aby sa dostala do cytoplazmy, ktorá sa má translatovať na funkčný proteín. Zdá sa, že mechanizmy vychytávania mRNA sú závislé od typu bunky a fyzikálno-chemické vlastnosti komplexov mRNA môžu výrazne ovplyvniť dodávanie buniek a distribúciu orgánov. Existujú dva základné prístupy na dodávanie mRNA vakcín, ktoré boli doteraz opísané. Najprv nanesenie mRNA do DC ex vivo , po ktorom nasleduje opätovná infúzia transfekovaných buniek58 ; a po druhé, priama parenterálna injekcia mRNA s nosičom alebo bez nosiča. Ex vivo DC zaťaženie umožňuje presnú kontrolu bunkového cieľa, účinnosti transfekcie a iných bunkových podmienok, ale ako forma bunkovej terapie je to drahý a pracovne náročný prístup k vakcinácii. Priama injekcia mRNA je pomerne rýchla a nákladovo efektívna, ale zatiaľ neumožňuje presné a efektívne dodávanie špecifické pre bunkový typ, hoci v tomto ohľade sa nedávno dosiahol pokrok59 . Oba tieto prístupy boli preskúmané v rôznych formách ( obr. 2 ; tabuľka 1 ).
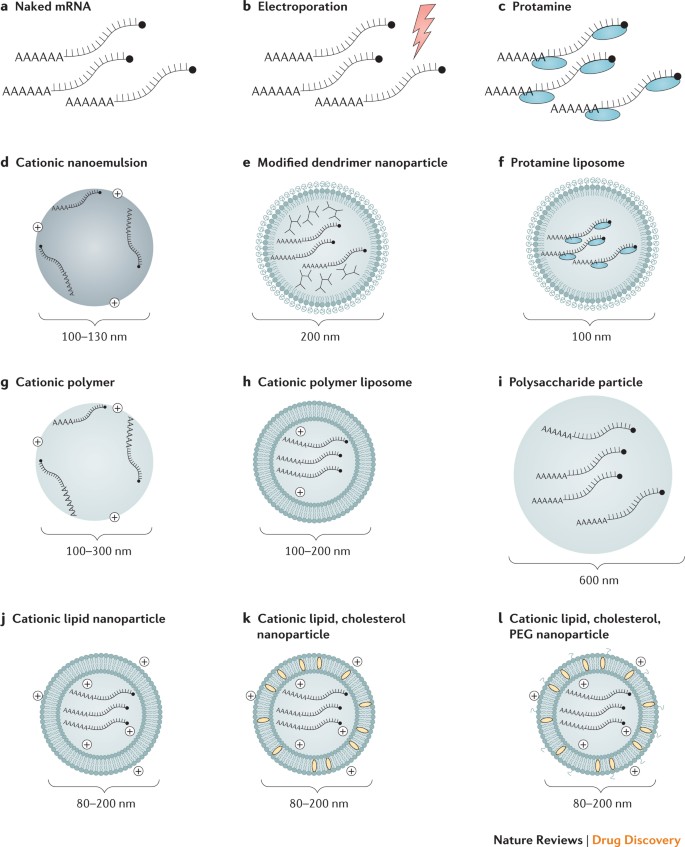
Bežne používané spôsoby dodávania a nosné molekuly pre mRNA vakcíny spolu s typickými priemermi pre časticové komplexy sú znázornené: nahá mRNA (časť a ); nahá mRNA s in vivo elektroporáciou (časť b ); mRNA s komplexom protamínu (katiónový peptid) (časť c ); mRNA spojená s kladne nabitou katiónovou nanoemulziou typu olej vo vode (časť d ); mRNA spojená s chemicky modifikovaným dendrimérom a v komplexe s polyetylénglykolom (PEG)-lipidom (časť e ); mRNA s protamínovým komplexom v PEG-lipidovej nanočastici (časť f ); mRNA asociovaná s katiónovým polymérom, ako je polyetylénimín (PEI) (časť g ); mRNA spojená s katiónovým polymérom, ako je PEI a lipidovou zložkou (časť h ); mRNA spojená s časticou alebo gélom polysacharidu (napríklad chitosan) (časť i ); mRNA v katiónovej lipidovej nanočastici (napríklad lipidy 1,2-dioleoyloxy-3-trimetylamóniumpropán (DOTAP) alebo dioleoylfosfatidyletanolamín (DOPE)) (časť j ); mRNA v komplexe s katiónovými lipidmi a cholesterolom (časť k ); a mRNA v komplexe s katiónovými lipidmi, cholesterolom a PEG-lipidom (časť 1 ).
PowerPointová snímka Obrázok v plnej veľkosti
Ex vivo zaťaženie DC. DC sú najsilnejšie bunky imunitného systému prezentujúce antigén. Iniciujú adaptívnu imunitnú odpoveď internalizáciou a proteolytickým spracovaním antigénov a ich prezentovaním CD8 + a CD4 + T bunkám na hlavných histokompatibilných komplexoch (MHC), konkrétne MHC triedy I a MHC triedy II , v tomto poradí. Okrem toho môžu DC prezentovať B bunkám intaktný antigén, aby vyvolali protilátkovú odpoveď60 . DC sú tiež vysoko prístupné transfekcii mRNA. Z týchto dôvodov DC predstavujú atraktívny cieľ pre transfekciu mRNA vakcínami, ako in vivo , tak aj ex vivo .
Hoci sa ukázalo, že DC internalizujú nahú mRNA prostredníctvom rôznych endocytických dráh 61 , 62 , 63 , účinnosť transfekcie ex vivo sa bežne zvyšuje pomocou elektroporácie; v tomto prípade molekuly mRNA prechádzajú cez membránové póry vytvorené vysokonapäťovým impulzom a priamo vstupujú do cytoplazmy (prehľad v odkaze 64 ). Tento prístup dodávania mRNA bol uprednostňovaný pre svoju schopnosť vytvárať vysokú účinnosť transfekcie bez potreby molekuly nosiča. DC, ktoré sú naplnené mRNA ex vivo, sa potom opätovne infúzia príjemcovi autológnej vakcíny, aby sa iniciovala imunitná odpoveď. Väčšina DC vakcín naplnených ex vivo vyvoláva prevažne bunkami sprostredkovanú imunitnú odpoveď; teda boli primárne používané na liečbu rakoviny (prehľad v odkaze 58 ).
Injekcia nahej mRNA in vivo. Nahá mRNA bola úspešne použitá na in vivo imunizácie, najmä vo formátoch , ktoré prednostne cielia nabunky prezentujúce antigén, ako pri intradermálnych61,65 a intranodálnych injekciách66,67,68 . Predovšetkým nedávna správa ukázala, že opakované intranodálne imunizácie s nahou, nemodifikovanou mRNA kódujúcou neoantigény spojené s nádorom vyvolali silné reakcie T buniek a zvýšili prežívanie bez progresie 68 (ďalej diskutované v rámčeku 2 ).
Metódy fyzického podávania in vivo. Na zvýšenie účinnosti vychytávania mRNA in vivo sa občas použili fyzikálne metódy na preniknutie bunkovou membránou. Skorá správa ukázala, že mRNA v komplexe s časticami zlata by sa mohla exprimovať v tkanivách pomocou génovej pištole, mikroprojektilovej metódy69 . Ukázalo sa, že génová pištoľ je účinný spôsob dodávania RNA a vakcinácie na myšacích modeloch 70 , 71 , 72 , 73 , ale nie sú dostupné žiadne údaje o účinnosti u veľkých zvierat alebo ľudí. In vivo elektroporácia sa tiež použila na zvýšenie príjmu terapeutickej RNA 74 , 75 , 76 ; v jednej štúdii však elektroporácia zvýšila imunogenicitu iba samoamplifikujúcej sa RNA a nie nereplikujúcej sa vakcíny na báze mRNA74 . Fyzikálne metódy môžu byť obmedzené zvýšenou bunkovou smrťou a obmedzeným prístupom k cieľovým bunkám alebo tkanivám. V poslednej dobe sa v tejto oblasti namiesto toho uprednostňuje použitie nanočastíc na báze lipidov alebo polymérov ako účinných a všestranných nosičov.
Protamín. Ukázalo sa, že katiónový peptidový protamín chráni mRNA pred degradáciou sérovými RNázami77 ; avšak samotná mRNA s protamínovým komplexom preukázala obmedzenú proteínovú expresiu a účinnosť v modeli vakcíny proti rakovine, pravdepodobne v dôsledku príliš úzkej asociácie medziprotamínom a mRNA36,78 . Tento problém bol vyriešený vývojom vakcínovej platformy RNActive, v ktorej protamínovo formulovaná RNA slúži len ako imunitný aktivátor a nie ako expresný vektor52 .
Dodávanie na báze katiónových lipidov a polymérov. Vysoko účinné reagencie na transfekciu mRNA založené na katiónových lipidoch alebo polyméroch, ako je TransIT-mRNA (Mirus Bio LLC) alebo Lipofectamine (Invitrogen), sú komerčne dostupné a dobre fungujú v mnohých primárnych bunkách a rakovinových bunkových líniách 9 , 13 , ale často vykazujú obmedzenú účinnosť in vivo alebo vysokú úroveň toxicity, nepublikované pozorovania (NP a D). Veľký pokrok sa dosiahol vo vývoji podobne navrhnutých komplexotvorných činidiel na bezpečné a účinné použitie in vivo a tieto sú podrobne diskutované v niekoľkých nedávnych prehľadoch 10 , 11 , 79 , 80 . Katiónové lipidy a polyméry, vrátane dendrimérov, sa v posledných rokoch stali široko používanými nástrojmi na podávanie mRNA. Pole mRNA jednoznačne profitovalo zo značnej investície do podávania malej interferujúcej RNA (siRNA) in vivo , kde sa tieto dodávacie vehikulá používali už viac ako desať rokov. Lipidové nanočastice (LNP) sa stali jedným z najatraktívnejších a bežne používaných nástrojov na dodávanie mRNA. LNP často pozostávajú zo štyroch zložiek: ionizovateľného katiónového lipidu, ktorý podporuje samouskladanie do častíc veľkosti vírusu (~100 nm) a umožňuje endozomálne uvoľňovanie mRNA do cytoplazmy; polyetylénglykol viazaný na lipidy (PEG), ktorý zvyšuje polčas rozpadu formulácií; cholesterol, stabilizačné činidlo; a prirodzene sa vyskytujúce fosfolipidy, ktoré podporujú štruktúru lipidovej dvojvrstvy. Početné štúdie preukázali účinné in vivo dodávanie siRNA prostredníctvom LNP (zhrnuté v odkaze 81 ), ale len nedávno sa ukázalo, že LNP sú účinnými nástrojmi na in vivo dodávanie samoamplifikujúcej sa RNA 19 a konvenčnej, nereplikujúcej sa mRNA 21 . Systémovo podávané komplexy mRNA-LNP sa zameriavajú hlavne na pečeň v dôsledku väzby apolipoproteínu E a následného vychytávania hepatocytmi sprostredkovaného receptorom82 a ukázalo sa, že intradermálne, intramuskulárne a subkutánne podanie spôsobuje predĺženú expresiu proteínuv mieste injekcie21,22 . Mechanizmy úniku mRNA do cytoplazmy nie sú úplne pochopené, a to nielen pre umelé lipozómy, ale aj pre prirodzene sa vyskytujúce exozómy83 . Ďalší výskum v tejto oblasti bude pravdepodobne veľkým prínosom pre oblasť terapeutickej dodávky RNA.
Veľkosť a trvanie produkcie proteínov in vivo z vakcín mRNA-LNP možno čiastočne kontrolovať zmenou spôsobu podávania. Ukázalo sa, že intramuskulárne a intradermálne podanie mRNA-LNP vedie k trvalejšej expresii proteínov ako systémové cesty podania: v jednom experimente bol polčas luciferázy svetlušiek kódovanej mRNA zhruba trikrát dlhší po intradermálnej injekcii ako po intravenóznom podaní21 . Táto kinetika expresie mRNA-LNP môže byť priaznivá na vyvolanie imunitných reakcií. Nedávna štúdia preukázala, že trvalá dostupnosť antigénu počas očkovania bola hnacou silou vysokých titrov protilátok a reakcií B buniek a T folikulárnych pomocných buniek (T FH ) 84 . Tento proces bol potenciálne prispievajúcim faktorom k účinnosti nedávno opísaných nukleozidmi modifikovaných mRNA-LNP vakcín podávaných intramuskulárnou a intradermálnou cestou 20 , 22 , 85 . V skutočnosti boli T FH bunky identifikované ako kritická populácia imunitných buniek, ktoré musia vakcíny aktivovať, aby vytvorili silné a dlhotrvajúce neutralizačné protilátkové reakcie, najmä proti vírusom, ktoré sa vyhýbajú humorálnej imunite86 . Dynamika GC reakcie a diferenciácia T FH buniek nie je úplne pochopená a pokrok v týchto oblastiach by bol nepochybne plodný pre budúci návrh vakcíny ( rámček 3 ).
Sahin a kolegovia sú priekopníkmi používania individualizovaných neoepitopových mRNA vakcín proti rakovine 121 . Používajú vysokovýkonné sekvenovanie na identifikáciu každej jedinečnej somatickej mutácie vzorky nádoru jednotlivého pacienta, ktorá sa nazýva mutanóm. To umožňuje racionálny návrh vakcín proti neoepitopovej rakovine spôsobom špecifickým pre pacienta a má tú výhodu, že sa zameriava na nevlastné antigénne špecificity, ktoré by nemali byť eliminované centrálnymi tolerančnými mechanizmami. Nedávno bol predložený dôkaz koncepcie: Kreiter a kolegovia zistili, že podstatná časť nesynonymných rakovinových mutácií bola imunogénna, keď bola dodaná mRNA a bola rozpoznaná hlavne CD4 + T bunkami176 . Na základe týchto údajov vytvorili výpočtovú metódu na predpovedanie neoepitopov obmedzených na hlavný histokompatibilný komplex (MHC) triedy II, ktoré možno použiť ako imunogény vakcín. mRNA vakcíny kódujúce takéto neoepitopy kontrolovali rast nádoru v myšacích modeloch B16-F10 melanómu a CT26 rakoviny hrubého čreva. V nedávnej klinickej štúdii Sahin a kolegovia vyvinuli personalizované mRNA vakcíny založené na neoepitopoch pre 13 pacientov s metastatickým melanómom, rakovinou známou vysokou frekvenciou somatických mutácií, a teda neoepitopov. Imunizovali sa proti desiatim neoepitopom na jednotlivca intranodálnou injekciou nahej mRNA. Reakcie CD4 + T buniek sa zistili proti väčšine neoepitopov a po niekoľkých mesiacoch sledovania sa pozorovala nízka frekvencia metastatického ochorenia68 . Je zaujímavé, že podobné výsledky sa získali aj v štúdii analogického dizajnu, ktorá používala syntetické peptidy ako imunogény a nie mRNA177 . Spoločne tieto nedávne štúdie naznačujú potenciálnu užitočnosť metodiky personalizovanej vakcíny.
Prevažná väčšina účinných antimikrobiálnych vakcín vyvoláva dlhotrvajúce ochranné protilátkové reakcie proti cieľovému patogénu. Protilátky s vysokou afinitou sa produkujú na špecializovaných mikroanatomických miestach v B bunkových folikuloch sekundárnych lymfoidných orgánov nazývaných germinálne centrá (GC). V GC dochádza k proliferácii B buniek, somatickej hypermutácii a selekcii na mutanty s vysokou afinitou a pre tieto procesy je potrebná účinná pomoc T buniek178 . Charakterizácia vzťahu medzi GC B a T bunkami bola v posledných rokoch aktívne študovaná. Folikulárny navádzací receptor CXC-chemokínový receptor 5 (CXCR5) bol identifikovaný na GC B a T bunkách v 90. rokoch 19. storočia 179 , 180 , ale koncept špecifickej línie T folikulárnych pomocných buniek (T FH ) bol navrhnutý až v roku 2000 (odkazy 1821 , 180 ). Existencia T FH línie bola potvrdená v roku 2009, keď bol identifikovaný transkripčný faktor špecifický pre T FH bunky, B bunkový lymfómový proteín 6 (BCL-6) , 183 , 184 , 185 . T FH bunky predstavujú špecializovanú podskupinu CD4 + T buniek, ktoré produkujú kritické signály pre prežitie, proliferáciu a diferenciáciu B buniek okrem signálov na zmenu izotypov protilátok a na zavedenie diverzifikačných mutácií do imunoglobulínových génov. Hlavné cytokíny produkované T FH bunkami sú interleukín-4 (IL-4) a IL-21, ktoré hrajú kľúčovú úlohu pri riadení GC reakcie. Ďalšie dôležité markery a funkčné ligandy exprimované T FH bunkami zahŕňajú CD40 ligand (CD40L), proteín 1A obsahujúci doménu Src homológnej domény 2 (SH2) (SH2D1A), proteín programovanej bunkovej smrti 1 (PD1) a indukovateľný kostimulátor T buniek (ICOS) 186 . Charakterizácia zriedkavých, široko neutralizujúcich protilátok proti HIV-1 odhalila, že nezvyčajne vysoké miery somatickej hypermutácie sú charakteristickým znakom ochranných protilátkových reakcií proti HIV-1 (odkaz 187 ). Keďže T FH bunky hrajú kľúčovú úlohu pri riadení tohto procesu v GC reakciách, je naliehavo potrebný vývoj nových adjuvans alebo vakcínových platforiem, ktoré môžu silne aktivovať tento typ buniek.
Vývoj profylaktických alebo terapeutických vakcín proti infekčným patogénom je najúčinnejším prostriedkom na potlačenie a prevenciu epidémií. Avšak konvenčné vakcínové prístupy do značnej miery zlyhali pri výrobe účinných vakcín proti náročným vírusom, ktoré spôsobujú chronické alebo opakované infekcie, ako je HIV-1, vírus herpes simplex a respiračný syncyciálny vírus (RSV). Okrem toho pomalé tempo vývoja a schvaľovania komerčných vakcín nie je dostatočné na to, aby reagovalo na rýchly výskyt akútnych vírusových ochorení, ako to dokazujú prepuknutia vírusov Ebola a Zika v rokoch 2014–2016. Preto je rozhodujúci vývoj silnejších a všestrannejších očkovacích platforiem.
Predklinické štúdie vytvorili nádej, že mRNA vakcíny budú spĺňať mnohé aspekty ideálnej klinickej vakcíny: preukázali priaznivý bezpečnostný profil u zvierat, sú všestranné a rýchlo sa navrhujú pre vznikajúce infekčné choroby a sú prístupné pre výrobu škálovateľnej správnej výrobnej praxe (GMP) (už prebieha v niekoľkých spoločnostiach). Na rozdiel od proteínovej imunizácie niekoľko formátov mRNA vakcín indukuje silné reakcie CD8 + T – buniek, pravdepodobne vďaka účinnej prezentácii endogénne produkovaných antigénov na molekulách MHC triedy I, okrem silných reakcií CD4 + T – buniek56,87,88 . Okrem toho, na rozdiel od imunizácie DNA, mRNA vakcíny preukázali schopnosť vytvárať silné neutralizačné protilátkové reakcie u zvierat iba s jednou alebo dvoma imunizáciami s nízkou dávkou20 , 22 , 85 . V dôsledku toho mRNA vakcíny vyvolali ochrannú imunitu proti rôznym infekčným agens na zvieracích modeloch 19 , 20 , 22 , 56 , 89 , 90, a preto vyvolali značný optimizmus. Nedávno publikované výsledky z dvoch klinických skúšok mRNA vakcín proti infekčným chorobám však boli trochu skromné, čo viedlo k opatrnejším očakávaniam o prenose predklinického úspechu na kliniku 22 , 91 (diskutované nižšie).
Proti infekčným patogénom sa použili dva hlavné typy RNA vakcín: samoamplifikujúce alebo replikónové RNA vakcíny a nereplikujúce sa mRNA vakcíny. Nereplikujúce sa mRNA vakcíny sa môžu ďalej rozlíšiť podľa spôsobu ich dodávania: ex vivo nanesenie DC alebo priama in vivo injekcia do rôznych anatomických miest. Ako je uvedené nižšie, v poslednej dobe bol publikovaný rýchlo rastúci počet predklinických štúdií v týchto oblastiach a niekoľko z nich vstúpilo do klinických štúdií na ľuďoch ( tabuľka 2 ).
Tabuľka 2 Klinické štúdie s mRNA vakcínami proti infekčným chorobám
Sponzorská inštitúcia Typ vakcíny (spôsob podania) Ciele Skúšobné čísla (fáza) Stav Argos Therapeutics DC EP s autológnymi vírusovými Ag a CD40L mRNA (id) HIV-1 • NCT00672191 (II)• NCT01069809 (II)• NCT02042248 (I) • Dokončené 105• Dokončené; výsledky NA• Dokončené; výsledky NA CureVac AG RNAktívna vírusová Ag mRNA (im, id) Vírus besnoty NCT02241135 (I) Aktívne 56 , 91 Erasmus Medical Center DC nabité vírusovou Ag mRNA s TriMix (i.nod.) HIV-1 NCT02888756 (II) Nábor Fundació Clinic na Recerca Biomèdica Vírusová Ag mRNA s TriMix (NA) HIV-1 NCT02413645 (I) Aktívne Massachusetts General Hospital DC nabité vírusovou Ag mRNA (id) HIV-1 NCT00833781 (II) Dokončené 104 Zdravotné stredisko McGill University DC EP s autológnymi vírusovými Ag a CD40L mRNA (id) HIV-1 NCT00381212 (I/II) Dokončené 102 Moderná terapia Nukleozidmi modifikovaná vírusová Ag mRNA (im) vírus zika NCT03014089 (I/II) Nábor 85 Vírus chrípky NCT03076385 (I) Priebežne 22
- V tabuľke sú zhrnuté klinické štúdie zaregistrované na ClinicalTrials.gov k 5. máju 2017. Ag, antigén; CD40L, CD40 ligand; DC, dendritická bunka; EP, elektroporované; id, intradermálne; im, intramuskulárne; i.nod., intranodálne; NA, nie je k dispozícii.
Väčšina v súčasnosti používaných vakcín so samoamplifikujúcou mRNA (SAM) je založená na alfavírusovom genóme92 , kde gény kódujúce mechanizmus replikácie RNA sú nedotknuté, ale gény kódujúce štrukturálne proteíny sú nahradené požadovaným antigénom. Plná RNA je dlhá ~ 9 kb a môže byť ľahko produkovaná IVT z DNA templátu. Platforma SAM umožňuje produkciu veľkého množstva antigénu z extrémne malej dávky vakcíny vďaka intracelulárnej replikácii RNA kódujúcej antigén. Skorá štúdia uviedla, že imunizácia 10 μg nahej vakcíny SAM kódujúcej fúziu RSV (F), hemaglutinín vírusu chrípky (HA) alebo premembránové a obalové (prM-E) proteíny luping ill vírusu viedli k protilátkovým odpovediam a čiastočnej ochrane pred letálnymi vírusovými infekciami u myší 93 . Vývoj RNA komplexotvorných činidiel priniesol pozoruhodné zlepšenie účinnosti SAM vakcín. Len 100 ng RNA replikónovej vakcíny kódujúcej RSV F, v komplexe s LNP, viedlo k silným imunitným reakciám T a B buniek u myší a 1 μg vyvolalo ochranné imunitné reakcie proti infekcii RSV v intranazálnom provokačnom systéme potkana bavlníka 19 . Vakcíny SAM kódujúce antigény vírusu chrípky v LNP alebo katiónová nanoemulzia typu olej vo vode vyvolali silné imunitné reakcie u fretiek a poskytli ochranu pred homológnou a heterológnou vírusovou infekciou u myší 94 , 95 , 96 . Ďalšie štúdie preukázali imunogenicitu tejto vakcínovej platformy proti rôznym vírusom u viacerých druhov, vrátane ľudského cytomegalovírusu (CMV), vírusu hepatitídy C a vírusu besnoty u myší, HIV-1 u králikov a HIV-1 a ľudskej CMV u makakov rhesus50 , 87 , 97 . Replikónová RNA kódujúca chrípkové antigény v komplexe s LNP obsahujúcimi chitosan alebo polyetylénimín (PEI) vyvolala u myší po subkutánnom podaní imunitné reakcie T a B buniek98,99 . Chahal a kolegovia vyvinuli aplikačnú platformu pozostávajúcu z chemicky modifikovaného, ionizovateľného dendriméru v komplexe do LNP 89 . Pomocou tejto platformy preukázali, že intramuskulárne podanie replikónov RNA kódujúcich antigény vírusu chrípky, vírusu Ebola alebo Toxoplasma gondii chránilo myši pred smrteľnou infekciou89 . Tá istá skupina nedávno preukázala, že vakcinácia RNA replikónom kódujúcim vírus Zika prM-E formulovaným rovnakým spôsobom vyvolala u myší odpovede antigén-špecifickej protilátky a CD8 + T buniek88 . Ďalšia nedávna štúdia uvádza imunogenicitu a miernu ochrannú účinnosť vakcín SAM proti bakteriálnym patogénom, menovite Streptococcus(skupiny A a B) spp., čo ďalej demonštruje všestrannosť tejto platformy 100 .
Jednou z výhod vakcín SAM je, že vytvárajú svoje vlastné adjuvans vo forme štruktúr dsRNA, replikačných medziproduktov a iných motívov, ktoré môžu prispieť k ich vysokej účinnosti. Avšak vnútorná povaha týchto PAMP môže sťažiť moduláciu zápalového profilu alebo reaktogenity SAM vakcín. Okrem toho sú obmedzenia veľkosti inzertu väčšie pre vakcíny SAM ako pre mRNA, ktoré nekódujú replikónové gény, a imunogenicita replikačných proteínov môže teoreticky obmedzovať opakované použitie.
Ako je opísané vyššie, ex vivo zavedenie DC je intenzívne využívaná metóda na vytvorenie bunkovo sprostredkovanej imunity proti rakovine. Vývoj vakcín proti infekčným chorobám s použitím tohto prístupu sa obmedzil najmä na terapeutickú vakcínu proti HIV-1: jedinci infikovaní HIV-1 na vysoko aktívnej antiretrovírusovej terapii boli liečení autológnymi DC elektroporovanými mRNA kódujúcou rôzne antigény HIV-1 a boli hodnotené bunkové imunitné odpovede 101 , 102 , 103 , 104 , 105 , 106. Tento zákrok sa ukázal ako bezpečný a vyvolal antigén-špecifické odpovede CD4 + a CD8 + T buniek, ale nebol pozorovaný žiadny klinický prínos. Ďalšia štúdia na ľuďoch hodnotila očkovanie DC s mRNA CMV pp65 u zdravých ľudských dobrovoľníkov a príjemcov alogénnych kmeňových buniek a zaznamenala indukciu alebo expanziu bunkových imunitných odpovedí špecifických pre CMV 107 .
Priamo injekčné, nereplikujúce sa mRNA vakcíny sú príťažlivým formátom vakcíny vďaka ich jednoduchému a ekonomickému podávaniu, najmä v prostredí s obmedzenými zdrojmi. Hoci skorá správa preukázala, že imunizácia mRNA kódujúcou nukleoproteíny chrípkového vírusu v komplexe s lipozómami vyvolala CTL reakcie u myší108 , prvá demonštrácia ochranných imunitných reakcií mRNA vakcínami proti infekčným patogénom bola publikovaná len pred niekoľkými rokmi18 . Táto kľúčová práca ukázala, že intradermálne podaná nekomplexovaná mRNA kódujúca rôzne antigény vírusu chrípky v kombinácii s adjuvans RNA s komplexom protamínu bola imunogénna na viacerých zvieracích modeloch a chránila myši pred letálnou vírusovou infekciou.
Imunizácia platformou RNActive na báze protamínu kódujúcou glykoproteín vírusu besnoty tiež vyvolala ochrannú imunitu proti letálnej infekcii intracerebrálnym vírusom u myší a silným neutralizačným protilátkovým reakciám u ošípaných56 . V nedávno publikovanej zásadnej práci Alberer a kolegovia hodnotili bezpečnosť a imunogenicitu tejto vakcíny u 101 zdravých ľudských dobrovoľníkov91 . Subjekty dostali 80–640 μg mRNA vakcíny trikrát injekčnou striekačkou s ihlou alebo zariadeniami bez ihly, buď intradermálne alebo intramuskulárne. Sedem dní po očkovaní takmer všetci účastníci hlásili mierne až stredne závažné reakcie v mieste vpichu a 78 % zaznamenalo systémovú reakciu (napríklad horúčku, bolesť hlavy a zimnicu). Vyskytla sa jedna závažná nežiaduca udalosť, ktorá pravdepodobne súvisela s vakcínou: prechodný a stredne ťažký prípad Bellovej obrny. Prekvapivo, injekcie injekčnej striekačky s ihlou nevytvorili detegovateľné neutralizačné protilátky u 98 % príjemcov. Na rozdiel od toho podávanie bez ihly vyvolalo premenlivé hladiny neutralizačných protilátok, z ktorých väčšina dosiahla vrchol nad očakávaným ochranným prahom, ale potom sa do značnej miery znížila po 1 roku u jedincov, ktorí boli dlhodobo sledovaní. Objasnenie základu rozdielnej imunogenicity medzi zvieratami a ľuďmi, ktorí dostali túto vakcínu, a medzi dvoma cestami podávania bude informatívne pre budúci návrh vakcíny s použitím tejto platformy.
Iné vakcíny proti infekčným chorobám úspešne využívajú dodávacie systémy na báze lipidov alebo polymérov. Katiónový 1,2-dioleoyloxy-3-trimetylamóniumpropán (DOTAP) a mRNA s komplexom lipidov dioleoylfosfatidyletanolamínu (DOPE) kódujúca HIV-1 gag generovala antigén-špecifické CD4 + a CD8 + T-bunkové reakcie po subkutánnom podaní u myší109 . Dve ďalšie štúdie preukázali, že mRNA s komplexom PEI by sa mohli účinne dodávať myšiam na vyvolanie imunitných reakcií špecifických pre HIV-1: subkutánne podaná mRNA kódujúca HIV-1 gag vyvolala reakcie CD4 + a CD8 + T buniek a intranazálne podaná mRNA kódujúca obalovú odpoveď gp120 gp120 v podjednotke nasového epitelu prekročila imunitnú dutinu nosnej dutiny. 110 , 111 . Kranz a kolegovia tiež vykonali intravenóznu imunizáciu u myší pomocou mRNA s lipidovým komplexom kódujúcej HA vírusu chrípky a preukázali aktiváciu T buniek po jednej dávke59 .
Nukleozidmi modifikované mRNA vakcíny predstavujú novú a vysoko účinnú kategóriu mRNA vakcín. Vďaka novosti tejto imunizačnej platformy sú naše poznatky o účinnosti obmedzené na výsledky štyroch nedávnych publikácií, ktoré demonštrovali účinnosť takýchto vakcín u malých a veľkých zvierat. Prvá publikovaná správa preukázala, že jediná intradermálna injekcia mRNA formulovanej s LNP kódujúcou vírus Zika prM-E, modifikovaná 1-metylpseudouridínom a purifikáciou FPLC, vyvolala ochranné imunitné reakcie u myší a makakov rhesus s použitím len 50 μg (0,02 mg kg / 2 makakov ) Následná štúdia inej skupiny testovala podobne navrhnutú vakcínu proti vírusu Zika na myšiach a zistila, že jediná intramuskulárna imunizácia vyvolala mierne imunitné reakcie a posilňovacia vakcinácia viedla k silným a ochranným imunitným reakciám85 . Táto vakcína tiež obsahovala modifikovaný nukleozid 1-metylpseudouridín, ale purifikácia FPLC alebo iné metódy odstraňovania kontaminantov dsRNA neboli opísané. Táto správa predovšetkým ukázala, že zosilnenie sekundárnej infekcie heterológnym flavivírusom, ktoré je hlavným problémom vakcín proti vírusu dengue a Zika, závislé od protilátok, by sa mohlo znížiť odstránením skrížene reaktívneho epitopu v proteíne E. Nedávna následná štúdia hodnotila rovnakú vakcínu na modeli očkovania matky a infekcie plodu112 . Dve imunizácie znížili infekciu vírusom Zika u fetálnych myší o niekoľko rádov a úplne zachránili defekt životaschopnosti plodu.
Ďalšia nedávna správa hodnotila imunogenicitu LNP-komplexovaných, nukleozidmi modifikovaných, FPLC nečistených mRNA vakcín proti chrípkovým HA 10 neuraminidázovým vírusom 8 (H10N8) a H7N9 chrípkovým vírusom u myší, fretiek, primátov (okrem človeka) a po prvýkrát aj u ľudí22 . Jediná intradermálna alebo intramuskulárna imunizácia nízkymi dávkami (0,4–10 μg) mRNA kódujúcej HA vírusu chrípky s komplexom LNP vyvolala u myší ochranné imunitné reakcie proti homológnej infekcii vírusom chrípky. Podobné výsledky sa získali u fretiek a opíc cynomolgus po imunizácii jednou alebo dvoma dávkami 50–400 μg vakcíny obsahujúcej LNP-komplexnú mRNA kódujúcu HA, čo potvrdzuje, že účinnosť vakcín mRNA–LNP sa prenáša na väčšie zvieratá, vrátane primátov (okrem človeka).
Na základe povzbudivých predklinických údajov sa nedávno začali dve klinické štúdie fázy I, aby sa po prvýkrát vyhodnotila imunogenicita a bezpečnosť vakcín mRNA-LNP modifikovaných nukleozidmi u ľudí. Vakcína mRNA kódujúca H10N8 HA v súčasnosti prechádza klinickým testovaním (NCT03076385) a boli hlásené predbežné zistenia pre 23 očkovaných jedincov22 . Účastníci dostali malé množstvo (100 μg) vakcíny intramuskulárne a imunogenicita sa merala 43 dní po očkovaní. Ukázalo sa, že vakcína je imunogénna u všetkých subjektov, ako bolo merané pomocou hemaglutinačnej inhibície a mikroneutralizačných protilátok. Sľubne boli titre protilátok nad očakávaným ochranným prahom, ale boli mierne nižšie ako na zvieracích modeloch. Podobne ako v štúdii Alberera a kol . 91 väčšina očkovaných subjektov hlásila miernu až strednú reaktogenitu (bolesť v mieste vpichu, myalgia, bolesť hlavy, únava a triaška) a tri subjekty hlásili závažné reakcie v mieste vpichu alebo systémovú reakciu podobnú bežnému prechladnutiu. Zdá sa , že táto úroveň reaktogenity je podobná ako u tradičnejších formátov vakcín113,114 . Nakoniec vakcína proti vírusu Zika opísaná Richnerom a kol . 85 , 112 tiež vstupuje do klinického hodnotenia v kombinovanom skúšaní fázy I/II (NCT03014089). Budúce štúdie, ktoré aplikujú vakcíny mRNA-LNP modifikované nukleozidmi proti väčšej rozmanitosti antigénov, odhalia, do akej miery je táto stratégia široko aplikovateľná na vakcíny proti infekčným chorobám.
Vakcíny proti rakovine založené na mRNA boli nedávno a rozsiahlo preskúmané 115 , 116 , 117 , 118 , 119 . Nižšie sú zvýraznené najnovšie pokroky a pokyny. Vakcíny proti rakovine a iné imunoterapie predstavujú sľubné alternatívne stratégie na liečbu malignít. Vakcíny proti rakovine môžu byť navrhnuté tak, aby sa zamerali na antigény spojené s nádorom, ktoré sú prednostne exprimované v rakovinových bunkách, napríklad rastové faktory alebo antigény, ktoré sú jedinečné pre malígne bunky v dôsledku somatickej mutácie120 . Tieto neoantigény alebo neoepitopy v nich obsiahnuté boli nasadené ako ciele mRNA vakcíny u ľudí 121 ( rámček 2 ). Väčšina vakcín proti rakovine je skôr terapeutická než profylaktická a snaží sa stimulovať bunkami sprostredkované reakcie, ako sú tie z CTL, ktoré sú schopné vyčistiť alebo znížiť nádorovú záťaž122 . Prvé štúdie proof-of-concept, ktoré nielen navrhli myšlienku vakcín proti rakovine RNA, ale poskytli aj dôkazy o uskutočniteľnosti tohto prístupu, boli publikované pred viac ako dvoma desaťročiami 123 , 124 . Odvtedy mnohé predklinické a klinické štúdie preukázali životaschopnosť mRNA vakcín v boji proti rakovine ( tabuľka 3 ).
Tabuľka 3 Klinické štúdie s mRNA vakcínami proti rakovine
Sponzorská inštitúcia Typ vakcíny (spôsob podania) Ciele Skúšobné čísla (fáza) Stav Univerzitná nemocnica v Antverpách DC EP s TAA mRNA (id alebo NA) AML • NCT00834002 (I)• NCT01686334 (II) • Dokončené 206 , 207• Nábor zamestnancov AML, CML, mnohopočetný myelóm NCT00965224 (II) Neznámy Viacnásobné solídne nádory NCT01291420 (I/II) Neznámy 208 mezotelióm NCT02649829 (I/II) Nábor Glioblastóm NCT02649582 (I/II) Nábor Argos Therapeutics DC EP s autológnou nádorovou mRNA s alebo bez CD40L mRNA (id alebo NA) Renálny bunkový karcinóm • NCT01482949 (II)• NCT00678119 (II)• NCT00272649 (I/II)• NCT01582672 (III)• NCT00087984 (I/II) • Priebežne• Dokončené 209• Dokončené; výsledky NA• Priebežne• Dokončené; výsledky NA Rakovina pankreasu NCT00664482 (NA) Dokončené; výsledky NA Bioterapeutiká Asterias DC nabité TAA mRNA (NA) AML NCT00510133 (II) Dokončené 210 BioNTech RNA Pharmaceuticals GmbH Nahá TAA alebo neo-Ag mRNA (i.nod.) Melanóm • NCT01684241 (I)• NCT02035956 (I) • Dokončené; výsledky NA• Priebežne TAA mRNA s lipozómovým komplexom (iv) Melanóm NCT02410733 (I) Nábor 59 TAA a neo-Ag mRNA formulovaná v lipozómoch (iv) Rakovina prsníka NCT02316457 (I) Nábor CureVac AG RNaktívna TAA mRNA (id) Nemalobunkový karcinóm pľúc • NCT00923312 (I/II)• NCT01915524 (I) • Dokončené 211• Ukončené 200 Rakovina prostaty • NCT02140138 (II)• NCT00831467 (I/II)• NCT01817738 (I/II) • Ukončené• Dokončené 151• Ukončené 212 Duke University DC nabité CMV Ag mRNA (id alebo ing.) Glioblastóm, malígny glióm • NCT00626483 (I)• NCT00639639 (I)• NCT02529072 (I)• NCT02366728 (II) • Priebežne 213• Priebežne 138 , 139• Nábor zamestnancov• Nábor zamestnancov DC nabité autológnou nádorovou mRNA (id) Glioblastóm NCT00890032 (I) Dokončené; výsledky NA DC, zrelé, naplnené TAA mRNA (i.nod.) Melanóm NCT01216436 (I) Ukončené Mozgová nemocnica Guangdong 999 DC nabité TAA mRNA (NA) Glioblastóm • NCT02808364 (I/II)• NCT02709616 (I/II) • Nábor zamestnancov• Nábor zamestnancov Mozgové metastázy NCT02808416 (I/II) Nábor Nemocnica Herlev DC nabité TAA mRNA (id) Rakovina prsníka, melanóm NCT00978913 (I) Dokončené 214 Rakovina prostaty NCT01446731 (II) Dokončené 215 Life Research Technologies GmbH DC, zrelé, naplnené TAA mRNA (NA) Rakovina vaječníkov NCT01456065 (I) Neznámy Univerzita Ľudovíta Maximiliána v Mníchove DC nabité TAA a CMV Ag mRNA (id) AML NCT01734304 (I/II) Nábor MD Anderson Cancer Center DC naplnené lyzátom AML a mRNA (NA) AML NCT00514189 (I) Ukončené Pamätník Sloan Kettering Cancer Center DC (Langerhans) EP s TAA mRNA (id) Melanóm NCT01456104 (I) Prebieha Mnohopočetný myelóm NCT01995708 (I) Nábor Univerzitná nemocnica Oslo DC nabité autológnym nádorom alebo TAA mRNA (id alebo NA) Melanóm • NCT00961844 (I/II)• NCT01278940 (I/II) • Ukončené• Dokončené 216 Rakovina prostaty • NCT01197625 (I/II)• NCT01278914 (I/II) • Nábor zamestnancov• Dokončené; výsledky NA Glioblastóm NCT00846456 (I/II) Dokončené 217 Rakovina vaječníkov NCT01334047 (I/II) Ukončené Radboudova univerzita DC EP s TAA mRNA (id a iv alebo i.nod) Kolorektálny karcinóm NCT00228189 (I/II) Dokončené 218 Melanóm • NCT00929019 (I/II)• NCT00243529 (I/II)• NCT00940004 (I/II)• NCT01530698 (I/II)• NCT02285413 (II) • Ukončené• Dokončené 219 , 220• Dokončené 220 , 221• Dokončené 144 , 220 , 221• Dokončené; výsledky NA Universitair Ziekenhuis Brussel DC EP s TAA a TriMix mRNA (id a iv) Melanóm • NCT01066390 (I)• NCT01302496 (II)• NCT01676779 (II) • Dokončené 137• Dokončené 140• Dokončené; výsledky NA Univerzitná nemocnica Erlangen DC, zrelé, naplnené autológnou nádorovou RNA (iv) Melanóm NCT01983748 (III) Nábor Univerzitná nemocnica Tübingen Autológna nádorová mRNA s proteínom GM-CSF (id a sc) Melanóm NCT00204516 (I/II) Dokončené 222 TAA mRNA v protamínovom komplexe s proteínom GM-CSF (id a sc) Melanóm NCT00204607 (I/II) Dokončené 150 Univerzita Campinas, Brazília DC nabité TAA mRNA (NA) AML, myelodysplastické syndrómy NCT03083054 (I/II) Nábor University of Florida RNActive * TAA mRNA (id) Rakovina prostaty NCT00906243 (I/II) Ukončené DC nabité CMV Ag mRNA s GM-CSF proteínom (id) Glioblastóm, malígny glióm NCT02465268 (II) Nábor
- V tabuľke sú zhrnuté klinické štúdie zaregistrované na ClinicalTrials.gov k 5. máju 2017. Ag, antigén; AML, akútna myeloidná leukémia; CD40L, CD40 ligand; CML, chronická myeloidná leukémia; CMV, cytomegalovírus; DC, dendritická bunka; EP, elektroporované; GM-CSF, faktor stimulujúci kolónie granulocytov a makrofágov; id, intradermálne; inguinálna injekcia; i.nod., intranodálna injekcia; iv, intravenózne; NA, nie je k dispozícii; neo-Ag, personalizovaný neoantigén; sc, subkutánne; TAA, antigén spojený s nádorom.
- * Vyvinutý spoločnosťou CureVac AG.
Keďže DC sú ústrednými hráčmi pri iniciovaní antigén-špecifických imunitných reakcií, zdalo sa logické využiť ich na imunoterapiu rakoviny. Prvý dôkaz, že DC elektroporované s mRNA by mohli vyvolať silné imunitné reakcie proti nádorovým antigénom, opísali Boczkowski a kolegovia v roku 1996 (odkaz 124 ). V tejto štúdii DC pulzované s mRNA kódujúcou ovalbumín (OVA) alebo RNA odvodenými od nádoru vyvolali imunitnú odpoveď redukujúcu nádor v modeloch exprimujúcich OVA a iných melanómových modeloch u myší. Boli identifikované rôzne imunitné regulačné proteíny vo forme adjuvancií kódovaných mRNA, ktoré môžu zvýšiť účinnosť vakcín proti rakovine DC. Niekoľko štúdií preukázalo, že elektroporácia DC s mRNA kódujúcou kostimulačné molekuly, ako je CD83, člen superrodiny receptora tumor nekrotizujúceho faktora 4 (TNFRSF4; tiež známy ako OX40) a ligand 4-1BB (4-1BBL) viedla k podstatnému zvýšeniu imunostimulačnej aktivity DC125,1127,126,126 ,. Funkcie DC môžu byť modulované aj použitím prozápalových cytokínov kódovaných mRNA, ako je IL-12, alebo molekúl spojených s transportom129,130,131 . Ako je uvedené vyššie, TriMix je zmes adjuvancií kódovaných mRNA (CD70, CD40L a konštitutívne aktívny TLR4), ktoré možno elektroporovať v kombinácii s mRNA alebo mRNA kódujúcou antigén132 . Táto formulácia sa ukázala ako účinná vo viacerých predklinických štúdiách zvýšením aktivácie DC a posunutím fenotypu CD4 + T buniek z T regulačných buniek na bunky podobné T pomocným 1 ( TH1 ) 132 , 133 , 134 , 135 , 136 . Je pozoruhodné, že imunizácia pacientov s melanómom štádia III alebo štádia IV pomocou DC naplnených mRNA kódujúcou antigény spojené s melanómom a adjuvans TriMix viedla k regresii nádoru u 27 % liečených jedincov137 . Teraz sa uskutočnilo viacero klinických štúdií s DC vakcínami zameranými na rôzne typy rakoviny, ako je metastatická rakovina prostaty, metastatická rakovina pľúc, karcinóm obličkových buniek, rakovina mozgu, melanóm, akútna myeloidná leukémia, rakovina pankreasu a iné 138 , 139 (prehľad v odkazoch 51 , 58 ).
Nová línia výskumu kombinuje elektroporáciu mRNA DC s tradičnými chemoterapeutickými činidlami alebo inhibítormi imunitných kontrolných bodov. V jednej štúdii boli pacienti s melanómom štádia III alebo IV liečení ipilimumabom, monoklonálnou protilátkou proti CTL antigénu 4 (CTLA4), a DC naplnené mRNA kódujúcou antigény spojené s melanómom plus TriMix. Táto intervencia viedla k trvalému zníženiu nádoru u časti jedincov s rekurentným alebo refraktérnym melanómom140 .
Spôsob podávania a formát podávania mRNA vakcín môže výrazne ovplyvniť výsledky. Boli vyvinuté rôzne formáty vakcín proti rakovine mRNA s použitím bežných spôsobov podávania (intradermálne, intramuskulárne, subkutánne alebo intranazálne) a niektorých nekonvenčných spôsobov vakcinácie (intranodálne, intravenózne, intrasplenické alebo intratumorálne).
Intranodálne podanie nahej mRNA je nekonvenčný, ale účinný spôsob podania vakcíny. Priama injekcia mRNA do sekundárneho lymfoidného tkaniva ponúka výhodu cieleného dodania antigénu do buniek prezentujúcich antigén v mieste aktivácie T buniek, čím sa eliminuje potreba migrácie DC. Niekoľko štúdií preukázalo , že intranodálne injikovaná holá mRNA môže byť selektívne prijímaná DC a môže vyvolať silné profylaktické alebo terapeutické protinádorové T bunkové reakcie62,66 ; skorá štúdia tiež preukázala podobné zistenia s intrasplenickým podaním141 . V niektorých prípadoch sa ukázalo , že spoločné podávanie DC-aktivujúceho proteínu FMS-príbuzného ligandu tyrozínkinázy 3 (FLT3L) ďalej zlepšuje imunitné reakcie na intranodálnu mRNA vakcináciu142,143 . Začlenenie adjuvans TriMix do intranodálnych injekcií myšiam s mRNA kódujúcou antigény spojené s nádorom viedlo k silným antigénovo špecifickým CTL reakciám a kontrole nádoru vo viacerých modeloch nádorov133 . Nedávnejšia štúdia preukázala, že intranodálna injekcia mRNA kódujúcej proteín E7 ľudského papilomavírusu (HPV) 16 pomocou TriMix zvýšila počet CD8 + T buniek infiltrujúcich nádor a inhibovala rast modelu nádoru exprimujúceho E7 u myší67 .
Úspech predklinických štúdií viedol k začatiu klinických štúdií s použitím intranodálne injikovanej holej mRNA kódujúcej antigény súvisiace s nádorom pacientom s pokročilým melanómom (NCT01684241) a pacientom s hepatocelulárnym karcinómom (EudraCT: 2012-005572-34). V jednej publikovanej štúdii boli pacienti s metastatickým melanómom liečení intranodálne podávanými DC elektroporovanými s mRNA kódujúcou s melanómom asociované antigény tyrozinázu alebo gp100 a TriMix, ktoré indukovali obmedzené protinádorové reakcie144 .
Intranazálne podávanie vakcíny je bezihlový, neinvazívny spôsob podávania, ktorý umožňuje rýchly príjem antigénu DC. Intranazálne podaná mRNA v komplexe s LNP Stemfect (Stemgent) viedla k oneskorenému nástupu nádoru a zvýšenému prežitiu v profylaktických a terapeutických modeloch myších nádorov s použitím OVA-exprimujúcej E.G7-OVA T lymfoblastickej bunkovej línie145 .
Intratumorálna vakcinácia mRNA je užitočný prístup, ktorý ponúka výhodu rýchlej a špecifickej aktivácie T buniek rezidentných v nádore. Tieto vakcíny často nezavádzajú mRNA kódujúce antigény spojené s nádorom, ale jednoducho sa zameriavajú na aktiváciu nádorovo špecifickej imunity in situ pomocou imunostimulačných molekúl. Skorá štúdia preukázala, že holá mRNA alebo protamínom stabilizovaná mRNA kódujúca gén nesúvisiaci s nádorom ( GLB1 ) zhoršovala rast nádoru a poskytovala ochranu na myšom modeli s glioblastómom, pričom využívala výhody vnútorných imunogénnych vlastností mRNA146 . Novšia štúdia ukázala, že intratumorálne podanie mRNA kódujúcej upravený cytokín založený na interferóne-β (IFNβ) fúzovanom s antagonistom transformujúceho rastového faktora β (TGFβ) zvýšilo cytolytickú kapacitu CD8 + T buniek a mierne oddialilo rast nádoru u myších modelov s lymfómom alebo karcinómom pľúc exprimujúcim OVA 147 . Ukázalo sa tiež, že intratumorálne podanie TriMix mRNA, ktorá nekóduje antigény spojené s nádorom, vedie k aktivácii CD8α + DC a nádorovo špecifických T buniek, čo vedie k oneskorenému rastu nádoru u rôznych myších modelov148 .
Systémové podávanie mRNA vakcín nie je bežné kvôli obavám z agregácie so sérovými proteínmi a rýchlej extracelulárnej degradácie mRNA; preto je nevyhnutné formulovať mRNA do nosných molekúl. Ako bolo diskutované vyššie, boli vyvinuté mnohé aplikačné formulácie na uľahčenie príjmu mRNA, zvýšenie proteínovej translácie a ochranu mRNA pred RNázami 10 , 11 , 79 , 80 . Ďalšou dôležitou otázkou je biodistribúcia mRNA vakcín po systémovom podaní. Určité katiónové komplexotvorné činidlá na báze LNP sa dodávajú intravenózne hlavne do pečene 21 , čo nemusí byť ideálne na aktiváciu DC. Nedávno bola opísaná účinná stratégia DC cielenia mRNA vakcín po systémovom podaní59 . Platforma na dodávanie mRNA-lipoplexu (komplex mRNA-lipozóm) bola vytvorená pomocou katiónových lipidov a neutrálnych pomocných lipidov formulovaných s mRNA a zistilo sa, že pomer lipidov k mRNA, a teda aj čistý náboj častíc, má zásadný vplyv na biodistribúciu vakcíny. Zatiaľ čo kladne nabitá lipidová častica sa primárne zameriavala na pľúca, záporne nabitá častica sa zameriavala na DC v sekundárnych lymfoidných tkanivách a kostnej dreni. Záporne nabité častice vyvolali silné imunitné reakcie proti nádorovo špecifickým antigénom, ktoré boli spojené s pôsobivou redukciou nádoru na rôznych myších modeloch59 . Keďže sa u myší alebo primátov (okrem človeka) nepozorovali žiadne toxické účinky, začali sa klinické štúdie využívajúce tento prístup na liečbu pacientov s pokročilým melanómom alebo trojnásobne negatívnym karcinómom prsníka (NCT02410733 a NCT02316457).
Rôzne bunky prezentujúce antigén sa nachádzajú v koži 149 , čo z nej robí ideálne miesto na dodávanie imunogénu počas vakcinácie ( obr. 3 ). Intradermálny spôsob podávania bol teda široko používaný pre vakcíny proti rakovine mRNA. Skorá semenná štúdia preukázala, že intradermálne podanie celkovej nádorovej RNA oneskorilo rast nádoru na myšom modeli s fibrosarkómom65 . Intradermálna injekcia mRNA kódujúcej nádorové antigény v platforme RNActive na báze protamínu sa ukázala ako účinná v rôznych myších modeloch rakoviny36 a vo viacerých profylaktických a terapeutických klinických nastaveniach ( tabuľka 3 ). Jedna takáto štúdia preukázala, že mRNA kódujúce survivín a rôzne antigény melanómového nádoru viedli k zvýšenému počtu antigén-špecifických T buniek v podskupine pacientov s melanómom150 . U ľudí s rakovinou prostaty rezistentnou na kastráciu vyvolala vakcína RNActive exprimujúca viaceré proteíny súvisiace s rakovinou prostaty u väčšiny príjemcov antigén-špecifické reakcie T- buniek151 . Nosiče na báze lipidov tiež prispeli k účinnosti intradermálne podávaných vakcín proti rakovine mRNA. Dodanie OVA-kódujúcej mRNA do DOTAP a/alebo DOPE lipozómov viedlo k antigén-špecifickej CTL aktivite a inhibovalo rast OVA-exprimujúcich nádorov u myší152 . V tej istej štúdii zlepšilo spoločné podávanie mRNA kódujúcej faktor stimulujúci kolónie granulocytov a makrofágov (GM-CSF) cytolytické reakcie špecifické pre OVA. Ďalšia správa ukázala, že subkutánne dodanie mRNA formulovanej s LNP kódujúcej dva antigény spojené s melanómom oneskorilo rast nádoru u myší a spoločné dodanie lipopolysacharidu (LPS) v LNP zvýšilo tak CTL, ako aj protinádorovú aktivitu153 . Vo všeobecnosti sa vakcíny proti rakovine mRNA ukázali ako imunogénne u ľudí, ale na dosiahnutie väčších klinických prínosov bude pravdepodobne potrebné ďalšie zdokonaľovanie metód očkovania, ako vyplýva zo základného imunologického výskumu.
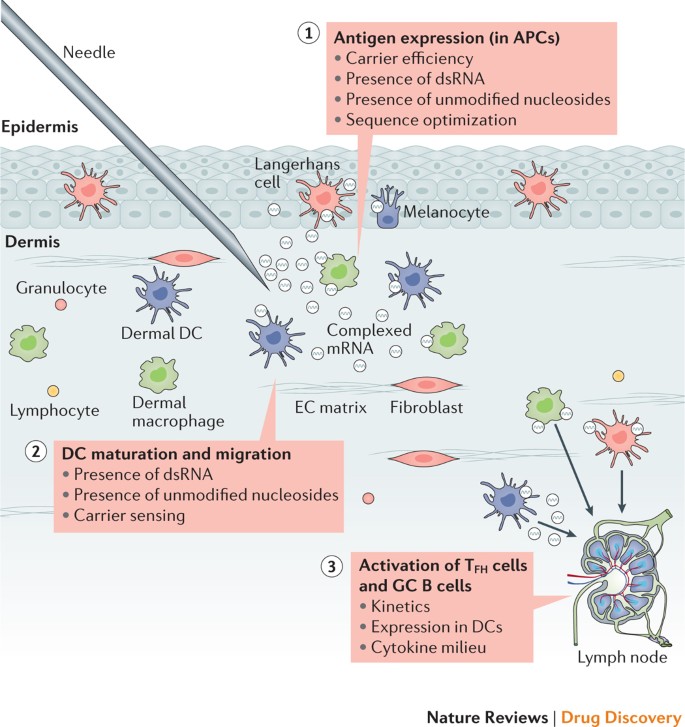
V prípade injikovanej mRNA vakcíny medzi hlavné faktory účinnosti patria nasledovné: úroveň expresie antigénu v profesionálnych bunkách prezentujúcich antigén (APC), ktorá je ovplyvnená účinnosťou nosiča, prítomnosťou patogénov spojených molekulárnych vzorcov (PAMP) vo forme dvojvláknovej RNA (dsRNA) alebo nemodifikovaných nukleozidov a úrovňou optimalizácie obsahu G5′-kodonu a obsahu G5′-kodonu. 3′ nepreložené oblasti (UTR) atď.); dozrievanie dendritických buniek (DC) a migrácia do sekundárneho lymfoidného tkaniva, ktorá je zvýšená PAMP; a schopnosť vakcíny aktivovať robustné reakcie B buniek pomocných T folikulárnych buniek (T FH ) a germinálnych centier (GC) – oblasť, ktorá je stále málo pochopená. Ako príklad je uvedená intradermálna injekcia. EC, extracelulárny.
PowerPointová snímka Obrázok v plnej veľkosti
Kombinácia vakcinácie mRNA s prídavnými terapiami, ako je tradičná chemoterapia, rádioterapia a inhibítory imunitných kontrolných bodov, zvýšila v niektorých predklinických štúdiách 154 , 155 priaznivý výsledok očkovania . Napríklad liečba cisplatinou významne zvýšila terapeutický účinok imunizácie mRNA kódujúcou HPV16 E7 onkoproteín a TriMix, čo viedlo k úplnému odmietnutiu nádorov ženského pohlavného traktu u myšacieho modelu67 . Predovšetkým sa tiež navrhlo , že liečba protilátkami proti proteínu programovanej bunkovej smrti 1 (PD1) zvýšila účinnosť vakcíny na báze neoepitopovej mRNA proti metastatickému melanómu u ľudí, ale na preskúmanie tejto hypotézy je potrebných viac údajov68 .
mRNA sa vyrába in vitro reakciami s rekombinantnými enzýmami, ribonukleotidtrifosfátmi (NTP) a templátom DNA; je teda rýchla a relatívne jednoduchá na výrobu v porovnaní s tradičnými platformami na produkciu proteínových podjednotiek a živých alebo inaktivovaných vírusových vakcín. Jeho reakčný výťažok a jednoduchosť umožňujú rýchlu produkciu mRNA v malom zariadení GMP. Výrobný proces je nezávislý od sekvencie a je primárne určený dĺžkou RNA, nukleotidom a chémiou uzáveru a čistením produktu; je však možné, že určité sekvenčné vlastnosti, ako je extrémna dĺžka, môžu predstavovať ťažkosti (DW, nepublikované pozorovania). Podľa súčasných skúseností môže byť proces štandardizovaný tak, aby produkoval takmer akýkoľvek kódovaný proteínový imunogén, čo ho robí obzvlášť vhodným pre rýchlu reakciu na vznikajúce infekčné choroby.
Všetky enzýmy a reakčné zložky potrebné na GMP produkciu mRNA možno získať od komerčných dodávateľov ako syntetizované chemikálie alebo bakteriálne exprimované činidlá bez živočíšnych zložiek, čím sa vyhnete bezpečnostným problémom súvisiacim s náhodnými látkami, ktoré trápia výrobu vakcín na báze bunkovej kultúry. Všetky zložky, ako je plazmidová DNA, fágové polymerázy, uzatváracie enzýmy a NTP, sú ľahko dostupné ako sledovateľné zložky GMP; niektoré z nich sú však v súčasnosti dostupné len v obmedzenom rozsahu alebo za vysoké náklady. Keď sa terapeutiká mRNA posúvajú smerom ku komercializácii a zvyšuje sa rozsah výroby, pre zdrojové materiály GMP sa môžu stať dostupnejšie ekonomickejšie možnosti.
GMP produkcia mRNA začína produkciou templátu DNA, po ktorej nasleduje enzymatická IVT a postupuje podľa rovnakého viackrokového protokolu, ktorý sa používa na syntézu vo výskumnom rozsahu, s pridanými kontrolami na zaistenie bezpečnosti a účinnosti produktu 16 . V závislosti od konkrétneho mRNA konštruktu a chémie môže byť protokol mierne upravený oproti tomu, čo je tu opísané, aby sa prispôsobili modifikovaným nukleozidom, stratégiám uzatvárania alebo odstráneniu templátu. Na začatie procesu produkcie sa templátová plazmidová DNA produkovaná v Escherichia coli linearizuje použitím reštrikčného enzýmu, aby sa umožnila syntéza odtokových transkriptov s poly(A) traktom na 3′ konci. Ďalej sa mRNA syntetizuje z NTP pomocou DNA-dependentnej RNA polymerázy z bakteriofága (ako je T7, SP6 alebo T3). Templátová DNA sa potom degraduje inkubáciou s DNázou. Nakoniec je mRNA enzymaticky alebo chemicky uzavretá, aby sa umožnila účinná translácia in vivo . Syntéza mRNA je vysoko produktívna a poskytuje viac ako 2 gl -1 mRNA plnej dĺžky v reakciách v multigramovom meradle za optimalizovaných podmienok.
Akonáhle je mRNA syntetizovaná, je spracovaná niekoľkými purifikačnými krokmi, aby sa odstránili reakčné zložky, vrátane enzýmov, voľných nukleotidov, zvyškovej DNA a skrátených fragmentov RNA. Zatiaľ čo precipitácia LiCl sa bežne používa na prípravu v laboratórnom meradle, purifikácia v klinickom meradle využíva derivatizované mikroguľôčky v dávkových alebo stĺpcových formátoch, ktoré sa ľahšie používajú vo veľkom meradle156,157 . Pre niektoré platformy mRNA je odstránenie dsRNA a iných kontaminantov rozhodujúce pre účinnosť konečného produktu, pretože je to silný induktor inhibície translácie závislej od interferónu. To sa dosiahlo FPLC s reverznou fázou v laboratórnom meradle 158 a skúmajú sa prístupy škálovateľného vodného čistenia. Potom, čo je mRNA purifikovaná, je vymenená do konečného skladovacieho pufra a sterilne filtrovaná na následné plnenie do liekoviek na klinické použitie. RNA je náchylná na degradáciu enzymatickými aj chemickými cestami157 . Formulačné pufre sa testujú, aby sa zaistilo, že neobsahujú kontaminujúce RNázy a môžu obsahovať zložky pufrov, ako sú antioxidanty a chelátory, ktoré minimalizujú účinky reaktívnych foriem kyslíka a dvojmocných kovových iónov, ktoré vedú k nestabilite mRNA159 .
Farmaceutická formulácia mRNA je aktívnou oblasťou vývoja. Hoci väčšina produktov pre štúdie v ranej fáze sa skladuje zmrazená (-70 °C), snahy o vývoj formulácií, ktoré sú stabilné pri vyšších teplotách vhodnejších na distribúciu vakcín, pokračujú. Publikované správy naznačujú, že možno pripraviť stabilné formulácie v chlade alebo pri izbovej teplote. Uvádza sa, že platforma RNActive je aktívna po lyofilizácii a skladovaní pri 5–25 °C počas 3 rokov a pri 40 °C počas 6 mesiacov91 . Iná správa preukázala , že lyofilizovaná nahá mRNA je stabilná aspoň 10 mesiacov v chladených podmienkach160 . Stabilita produktov mRNA sa môže zlepšiť aj balením do nanočastíc alebo spoločnou formuláciou s inhibítormi RNázy161 . Pre mRNA zapuzdrenú v lipidoch bola pozorovaná najmenej 6 mesačná stabilita (Arbutus Biopharma, osobná komunikácia), ale dlhodobé skladovanie takýchto komplexov mRNA-lipid v nezmrazenej forme ešte nebolo hlásené.
Neexistujú žiadne špecifické usmernenia od FDA alebo Európskej liekovej agentúry (EMA) pre produkty vakcíny mRNA. Rastúci počet klinických skúšok vykonaných pod dohľadom EMA a FDA však naznačuje, že regulačné orgány akceptovali prístupy navrhované rôznymi organizáciami, aby preukázali, že produkty sú bezpečné a prijateľné na testovanie na ľuďoch. Pretože mRNA spadá do širokej vakcínovej kategórie genetických imunogénov, mnohé z hlavných princípov, ktoré boli definované pre DNA vakcíny 162 a vektory génovej terapie 163 , 164, možno pravdepodobne aplikovať na mRNA s určitými úpravami, aby odrážali jedinečné vlastnosti mRNA. Podrobný prehľad predpisov EMA pre RNA vakcíny od Hinza a kolegov zdôrazňuje rôzne regulačné cesty stanovené pre profylaktické infekčné choroby oproti terapeutickým aplikáciám165 . Bez ohľadu na špecifickú klasifikáciu v rámci existujúcich usmernení možno niektoré témy pozorovať v tom, čo je uvedené v týchto usmerneniach a v tom, čo bolo oznámené pre nedávno publikované klinické štúdie. Najmä nedávna správa o mRNA vakcíne proti vírusu chrípky vyzdvihuje predklinické a klinické údaje preukazujúce biodistribúciu a perzistenciu u myší, ochranu pred chorobou v príslušnom zvieracom modeli (fretky) a imunogenicitu, lokálnu reaktogenitu a toxicitu u ľudí22 . Keďže produkty mRNA sa stávajú čoraz významnejšími v oblasti vakcín, je pravdepodobné, že sa vyvinú špecifické usmernenia, ktoré vymedzia požiadavky na výrobu a hodnotenie nových vakcín mRNA. Schválené v EP – tu čítaj
Požiadavka na bezpečnosť moderných profylaktických vakcín je mimoriadne prísna, pretože vakcíny sa podávajú zdravým jedincom. Pretože proces výroby mRNA nevyžaduje toxické chemikálie alebo bunkové kultúry, ktoré by mohli byť kontaminované náhodnými vírusmi, produkcia mRNA sa vyhýba bežným rizikám spojeným s inými očkovacími platformami, vrátane živých vírusov, vírusových vektorov, inaktivovaných vírusov a podjednotkových proteínových vakcín. Okrem toho krátky čas výroby mRNA predstavuje málo príležitostí na zavedenie kontaminujúcich mikroorganizmov. U očkovaných ľudí sa teoretické riziká infekcie alebo integrácie vektora do DNA hostiteľskej bunky netýkajú mRNA. Z vyššie uvedených dôvodov sa mRNA vakcíny považovali za relatívne bezpečný formát vakcíny.
Teraz bolo testovaných niekoľko rôznych mRNA vakcín od fázy I do IIb klinických štúdií a ukázalo sa, že sú bezpečné a primerane dobre tolerované ( tabuľky 2 , 3 ). Nedávne štúdie na ľuďoch však preukázali mierne a v zriedkavých prípadoch závažné reakcie v mieste vpichu alebo systémové reakcie pre rôzne platformy mRNA22,91 . Potenciálne obavy týkajúce sa bezpečnosti, ktoré sa pravdepodobne vyhodnotia v budúcich predklinických a klinických štúdiách, zahŕňajú lokálny a systémový zápal, biodistribúciu a perzistenciu exprimovaného imunogénu, stimuláciu auto-reaktívnych protilátok a potenciálne toxické účinky akýchkoľvek nepôvodných nukleotidov a komponentov dodávacieho systému. Možnou obavou by mohlo byť, že niektoré očkovacie platformy na báze mRNA54,166 indukujú silné reakcie interferónu typu I, ktoré sú spojené nielen so zápalom, ale potenciálne aj s autoimunitou167,168 . Identifikácia jedincov so zvýšeným rizikom autoimunitných reakcií pred očkovaním mRNA teda môže umožniť prijatie primeraných opatrení. Ďalší potenciálny bezpečnostný problém by mohol vyplývať z prítomnosti extracelulárnej RNA počas vakcinácie mRNA. Ukázalo sa, že extracelulárna holá RNA zvyšuje permeabilitu tesne zbalených endotelových buniek a môže tak prispievať k edému169 . Ďalšia štúdia ukázala, že extracelulárna RNA podporuje zrážanlivosť krvi a patologickú tvorbu trombu170 . Bezpečnosť si preto bude vyžadovať nepretržité hodnotenie, pretože rôzne modality mRNA a systémy podávania sa používajú po prvýkrát u ľudí a testujú sa na väčších populáciách pacientov.
V súčasnosti mRNA vakcíny zažívajú prudký nárast v základnom a klinickom výskume. Len za posledné 2 roky sme boli svedkami publikovania desiatok predklinických a klinických správ preukazujúcich účinnosť týchto platforiem. Zatiaľ čo väčšina skorých prác v oblasti mRNA vakcín sa zamerala na aplikácie proti rakovine, množstvo nedávnych správ preukázalo silu a všestrannosť mRNA na ochranu pred širokou škálou infekčných patogénov, vrátane vírusu chrípky, vírusu Ebola, vírusu Zika, Streptococcus spp. a T. gondii ( tabuľky 1 , 2 ).
Zatiaľ čo predklinické štúdie priniesli veľký optimizmus, pokiaľ ide o vyhliadky a výhody vakcín na báze mRNA, dve nedávne klinické správy viedli k miernejším očakávaniam 22 , 91 . V oboch štúdiách bola imunogenicita u ľudí miernejšia, ako sa očakávalo na zvieracích modeloch, čo je fenomén pozorovaný aj pri vakcínach na báze DNA171 a vedľajšie účinky neboli triviálne. Upozorňujeme, že tieto štúdie predstavujú iba dve variácie platforiem vakcín mRNA a pri zmene expresných a imunostimulačných profilov vakcíny môžu existovať podstatné rozdiely. Je potrebný ďalší výskum, aby sa zistilo, ako rôzne živočíšne druhy reagujú na zložky vakcíny mRNA a zápalové signály a ktoré dráhy imunitnej signalizácie sú u ľudí najúčinnejšie.
Nedávne pokroky v porozumení a redukcii vrodeného imunitného snímania mRNA pomohli úsiliu nielen pri aktívnej vakcinácii, ale aj v niekoľkých aplikáciách pasívnej imunizácie alebo pasívnej imunoterapie pri infekčných chorobách a rakovine ( rámček 4 ). Priame porovnania medzi platformami expresie mRNA by mali objasniť, ktoré systémy sú najvhodnejšie pre pasívnu aj aktívnu imunizáciu. Vzhľadom na veľký počet sľubných platforiem mRNA by ďalšie priame porovnania boli pre oblasť vakcín nanajvýš cenné, pretože by to výskumníkom umožnilo zamerať zdroje na tie, ktoré sa najlepšie hodia pre každú aplikáciu.
Rýchle tempo pokroku vo vakcínach mRNA by nebolo možné bez veľkých nedávnych pokrokov v oblasti vrodeného imunitného snímania RNA a metód dodávania in vivo . Rozsiahly základný výskum v oblasti RNA a biochémie lipidov a polymérov umožnil previesť mRNA vakcíny do klinických skúšok a viedol k úžasnej úrovni investícií do spoločností zaoberajúcich sa mRNA vakcínami ( tabuľka 4 ). Moderna Therapeutics, založená v roku 2010, získala takmer 2 miliardy USD kapitálu s plánom na komercializáciu vakcín a terapií na báze mRNA 172 , 173 . Americký úrad pre biomedicínsky pokročilý výskum a vývoj (BARDA) sa zaviazal podporiť klinické hodnotenie spoločnosti Moderna sľubnej nukleozidmi modifikovanej mRNA vakcíny pre vírus Zika (NCT03014089). V Nemecku má CureVac AG rozširujúce sa portfólio terapeutických cieľov 174 vrátane rakoviny a infekčných chorôb a BioNTech vyvíja inovatívny prístup k personalizovanej medicíne rakoviny pomocou mRNA vakcín 121 ( rámček 2 ). Premena základného výskumu do klinického testovania je tiež výhodnejšia vďaka komercializácii vlastných GMP produktov spoločnosťami ako New England Biolabs a Aldevron 175 . Napokon, nedávne spustenie Koalície pre inovácie v pripravenosti na epidémiu (CEPI) poskytuje veľký optimizmus pre budúce reakcie na vznikajúce vírusové epidémie. Cieľom tohto nadnárodného verejného a súkromného partnerstva je získať 1 miliardu dolárov na vývoj vakcín založených na platforme, ako je napríklad mRNA, aby sa rýchlo obmedzili vznikajúce epidémie skôr, ako sa vymknú spod kontroly.
Tabuľka 4 Poprední vývojári vakcín mRNA: zameranie výskumu, partneri a terapeutické platformy
Inštitúcia technológia mRNA Partneri Indikácia (cieľ choroby) Biotechnológia Argos mRNA neoantigény (platforma Arcelis) NA Individualizované vakcíny proti rakovine, HIV-1 BioNTech RNA Pharmaceuticals GmbH Nukleozidmi modifikovaná mRNA (IVAC Mutanóm, FixVAC) Genentech/Roche Individualizované vakcíny proti rakovine Bayer AG Veterinárne vakcíny CureVac AG Sekvenčne optimalizovaná, purifikovaná mRNA (RNActive, RNArt, RNAdjuvant) Boehringer Ingelheim GmbH Vakcíny proti rakovine (rakovina pľúc) Johnson & Johnson Vírusové vakcíny Sanofi Pasteur Vakcíny proti infekčným chorobám BMGF Vakcíny proti infekčným chorobám IAVI vakcíny proti HIV Imunoterapie eTheRNA Purifikovaná mRNA (TriMix) NA Rakovina (melanóm, prsník), vírusové vakcíny (HBV a/alebo HPV) GlaxoSmithKline/Novartis Samozosilňujúca sa mRNA (SAM) (replikón alfavírusu) NA Vakcíny proti infekčným chorobám Moderná terapia Nukleozidmi modifikovaná mRNA Spoločnosť Merck & Co. Individualizované vakcíny proti rakovine, vírusové vakcíny BMGF, DARPA, BARDA Vírusové vakcíny (vírus chrípky, CMV, HMPV, PIV, vírus chikungunya, vírus Zika) University of Pennsylvania Nukleozidmi modifikovaná purifikovaná mRNA NA Vakcíny proti infekčným chorobám
- BARDA, Biomedical Advanced Research and Development Authority; BMGF, Nadácia Billa a Melindy Gatesových; CMV, cytomegalovírus; DARPA, Agentúra pre pokročilé obranné výskumné projekty; HBV, vírus hepatitídy B; HMPV, ľudský metapneumovírus; HPV, ľudský papilomavírus; IAVI, International AIDS Vaccine Initiative; NA, nie je k dispozícii; PIV, vírus parainfluenzy.
udúcnosť mRNA vakcín je preto mimoriadne jasná a klinické údaje a zdroje poskytnuté týmito spoločnosťami a inými inštitúciami budú pravdepodobne podstatne stavať na základnom výskume terapeutík založených na mRNA a oživiť ho.
Rekombinantné monoklonálne protilátky rýchlo transformujú farmaceutický trh a stali sa jednou z najúspešnejších terapeutických tried na liečbu autoimunitných porúch, infekčných chorôb, osteoporózy, hypercholesterolémie a rakoviny 188 , 189 , 190 , 191 , 192. Vysoké náklady na výrobu proteínov a potreba častého systémového podávania však predstavujú hlavné obmedzenie ich širokej dostupnosti. Technológie prenosu protilátok a génov by mohli tieto ťažkosti potenciálne prekonať, pretože pacientom podávajú nukleotidové sekvencie kódujúce monoklonálne protilátky, čo umožňuje in vivo produkciu správne poskladaných a modifikovaných proteínových terapeutík 193. Boli skúmané viaceré vektory génovej terapie (napríklad vírusové vektory a plazmidová DNA), ktoré majú obmedzenia, ako je preexistujúca imunita hostiteľa, získaná imunita proti vektoru, vysoká vrodená imunogenicita, ťažkosti s reguláciou produkcie protilátok in vivo a toxické účinky 193 , 194. mRNA terapeutiká kombinujú bezpečnosť s vynikajúcou kontrolou dávky a potenciálom pre viacnásobné podávanie bez preexistujúcej alebo imunity proti vektoru. Dve skoré správy preukázali, že dendritické bunky (DC) elektroporované mRNA kódujúcimi protilátky proti imunoinhibičným proteínom vylučovali funkčné protilátky a zlepšili imunitné odpovede u myší 195 , 196. Tri nedávne publikácie opisujú použitie injekčnej mRNA na in vivo produkciu terapeutických protilátok: Pardi a kolegovia preukázali, že jednorazová intravenózna injekcia myšiam s mRNA modifikovanými nukleozidmi, enkapsulovanými lipidovými nanočasticami (LNP), kódujúcimi ťažké a ľahké reťazce protilátky VRC01 neutralizujúcej HIV-1, rýchlo produkovala vysoké hladiny funkčných protilátok v sére a chránila humanizované myši pred infekciou HIV-1 197 ; Stadler a kolegovia preukázali, že intravenózne podanie nízkych dávok mRNA modifikovaných nukleozidmi v komplexe s TransIT (Mirus Bio LLC) kódujúcich rôzne bispecifické protilátky proti rakovine viedlo k eliminácii veľkých nádorov v myšacích modeloch 198 ; a Thran a kolegovia 199 použili nemodifikovaný systém podávania mRNA-LNP 12na expresiu troch monoklonálnych protilátok v hladinách, ktoré chránia pred letálnym napadnutím vírusom besnoty, botulotoxínom a bunkovou líniou B bunkového lymfómu. V žiadnej z týchto štúdií neboli pozorované žiadne toxické účinky. Tieto pozorovania naznačujú, že mRNA ponúka bezpečnú, jednoduchú a účinnú alternatívu k podávaniu terapeutického proteínu monoklonálnej protilátky s potenciálnou aplikáciou na akýkoľvek terapeutický proteín.
Springer Nature zostáva neutrálny, pokiaľ ide o jurisdikčné nároky v publikovaných mapách a inštitucionálnych afiliáciách.
DW podporil National Institute of Allergy and Infectious Disease (NIAID) amerického Národného inštitútu zdravia (NIH) pod číslami ocenení CHAVI-ID UM1-AI100645, R01-AI050484, R01-AI124429 a R01-AI084860, grantom od Gatesa CollaCAV Gates pre vakcíny AIDS OPP1033102, od Agentúry pre obranné pokročilé výskumné projekty v rámci grantu HR0011-17-2-0069 a od divízie New Frontier Sciences spoločnosti Takeda Pharmaceuticals. FWP bol podporený grantom Centra pre HIV/AIDS vakcínovú imunológiu a objavovanie imunogénov (CHAVI-ID) UM1-AI100645, grantom Agentúry pre obranné pokročilé výskumné projekty HR0011-17-2-0069 a grantom Gatesovej nadácie OPP1066832. Autori oceňujú K. Karikó za jej veľmi užitočné rady.
V súlade so zásadami a postupmi Pensylvánskej univerzity a našimi etickými záväzkami ako výskumníkov uvádzame, že Norbert Pardi, Michael J. Hogan a Drew Weissman sú menovaní na patentoch, ktoré popisujú použitie nukleozidmi modifikovanej mRNA ako platformy na dodávanie terapeutických proteínov a vakcín. O týchto záujmoch sme v plnej miere informovali University of Pennsylvania a máme schválený plán na riadenie akýchkoľvek potenciálnych konfliktov vyplývajúcich z udeľovania licencií na naše patenty. Frederick Porter neuvádza žiadne konkurenčné finančné záujmy.
Dendritická bunka
(DC). Profesionálna bunka prezentujúca antigén, ktorá môže silne aktivovať CD4 + a CD8 + T bunky prezentáciou peptidových antigénov na molekulách hlavného histokompatibilného komplexu (MHC) triedy I a II spolu s kostimulačnými molekulami.Molekulárny vzor spojený s patogénom
(PAMP). Zachovaná molekulárna štruktúra produkovaná mikroorganizmami a rozpoznaná ako signál nebezpečenstva zápalu rôznymi vrodenými imunitnými receptormi.Interferón typu I
Rodina proteínov, vrátane, bez toho aby bol výpočet obmedzujúci, interferónu-p (IFNp) a viacerých izoforiem IFNa, uvoľňovaných bunkami v reakcii na vírusové infekcie a patogénne produkty. Snímanie IFN typu I má za následok upreguláciu interferónom stimulovaných génov a antivírusový bunkový stav.Rýchla proteínová kvapalinová chromatografia
(FPLC). Forma kvapalinovej chromatografie, ktorá sa môže použiť na čistenie proteínov alebo nukleových kyselín. Vysokoúčinná kvapalinová chromatografia (HPLC) je podobný prístup, ktorý využíva vysoký tlak na čistenie materiálov.Nukleozidová modifikácia
Začlenenie chemicky modifikovaných nukleozidov, ako je pseudouridín, 1-metylpseudouridín, 5-metylcytidín a iné, do transkriptov mRNA, zvyčajne na potlačenie vrodeného imunitného snímania a/alebo na zlepšenie translácie.Adjuvans
Prísada do vakcín, ktorá moduluje a/alebo zvyšuje potenciu imunitnej odpovede, čo často umožňuje efektívne použitie nižších dávok antigénu. Adjuvans môžu byť založené na molekulových vzoroch spojených s patogénom (PAMP) alebo na iných molekulách, ktoré aktivujú vrodené imunitné senzory.MHC trieda I
Polymorfný súbor proteínov exprimovaných na povrchu všetkých jadrových buniek, ktoré prezentujú antigén CD8 + (vrátane cytotoxických) T lymfocytov vo forme proteolyticky spracovaných peptidov, typicky s dĺžkou 8–11 aminokyselín.MHC triedy II
Polymorfný súbor proteínov exprimovaných na profesionálnych bunkách prezentujúcich antigén a určitých iných typoch buniek, ktoré prezentujú antigén CD4 + (pomocným) T bunkám vo forme proteolyticky spracovaných peptidov, typicky s dĺžkou 11–30 aminokyselín.Dobrá výrobná prax
(GMP). Súbor pokynov a postupov navrhnutých tak, aby zaručili výrobu trvalo vysokokvalitných a bezpečných farmaceutických produktov. Na klinické skúšky na ľuďoch sa musia používať materiály triedy GMP.Pasívna imunizácia alebo pasívna imunoterapia
Na rozdiel od tradičných (aktívnych) vakcín tieto terapie nevytvárajú imunitné reakcie de novo , ale môžu poskytnúť imunitne sprostredkovanú ochranu prostredníctvom dodania protilátok alebo génov kódujúcich protilátky. Pasívne očkovanie ponúka výhodu okamžitého zásahu, ale nevýhodu vysokej ceny.
Zdroj https://www.nature.com
Tiež pozri tu:
mRNA sprostredkuje pasívnu vakcináciu proti infekčným agens, toxínom a nádorom
Článok
K dispozícii plné znenie
ZobraziťZobraziť abstrakt
Imunogénna osobná neoantigénová vakcína pre pacientov s melanómom
Článok
K dispozícii plné znenie
ZobraziťZobraziť abstrakt
Článok
K dispozícii plné znenie
ZobraziťZobraziť abstrakt
Článok
K dispozícii plné znenie
ZobraziťZobraziť abstrakt
Súčasný stav a klinické vyhliadky prenosu génov pre protilátky
Článok
K dispozícii plné znenie
ZobraziťZobraziť abstrakt
Predklinický a klinický dôkaz imunogenicity mRNA vakcín proti vírusom chrípky H10N8 a H7N9
Článok
K dispozícii plné znenie
ZobraziťZobraziť abstrakt
RNA senzory vrodeného imunitného systému a ich detekcia patogénov
Článok
K dispozícii plné znenie
ZobraziťZobraziť abstrakt
Článok
K dispozícii plné znenie
ZobraziťZobraziť abstrakt
Článok
K dispozícii plné znenie
ZobraziťZobraziť abstrakt
Terapeutické protilátky na infekčné choroby
Článok
K dispozícii plné znenie
Tfh bunky a HIV bnAbs, model imunodominancie problému tvorby protilátok neutralizujúcich HIV
Článok
K dispozícii plné znenie
ZobraziťZobraziť abstrakt
Článok
K dispozícii plné znenie
ZobraziťZobraziť abstrakt
Článok
K dispozícii plné znenie
ZobraziťZobraziť abstrakt
Sľub a problémy spojené s použitím rekombinantného AAV na dodávanie anti-HIV protilátok
Článok
K dispozícii plné znenie
ZobraziťZobraziť abstrakt
Článok
K dispozícii plné znenie
ZobraziťZobraziť abstrakt
Článok
K dispozícii plné znenie
ZobraziťZobraziť abstrakt
Článok
K dispozícii plné znenie
ZobraziťZobraziť abstrakt
Stabilita endogénnej a pridanej RNA v krvných vzorkách, sére a plazme
Článok
ZobraziťZobraziť abstrakt
Článok
ZobraziťZobraziť abstrakt
Článok
ZobraziťZobraziť abstrakt
Očkovanie dendritickými bunkami pri malígnom mezotelióme pleury: Štúdia fázy I/II.
Článok
Článok
ZobraziťZobraziť abstrakt
Vakcínou sprostredkovaná ochrana proti vrodenému ochoreniu vyvolanému vírusom Zika
Článok
ZobraziťZobraziť abstrakt
Personalizované RNA mutanómové vakcíny mobilizujú polyšpecifickú terapeutickú imunitu proti rakovine
Článok
ZobraziťZobraziť abstrakt
Imunogenicita terapie dendritickými bunkami AGS-004 u pacientov liečených počas akútnej infekcie HIV
Článok
ZobraziťZobraziť abstrakt
Eliminácia veľkých nádorov u myší bišpecifickými protilátkami kódovanými mRNA
Článok
ZobraziťZobraziť abstrakt
Dlhodobé prežitie pri glioblastóme s cytomegalovírusom pp65-cielené očkovanie
Článok
ZobraziťZobraziť abstrakt
Článok
ZobraziťZobraziť abstrakt
Článok
ZobraziťZobraziť abstrakt
mRNA vakcíny proti rakovine – správy, ktoré prevládajú
kapitola
ZobraziťZobraziť abstrakt
Modifikované mRNA vakcíny chránia pred infekciou vírusom Zika
Článok
Článok
ZobraziťZobraziť abstrakt
Biofarmaceutiká: Referenčné produkty a biologicky podobné lieky na liečbu zápalových ochorení
Článok
ZobraziťZobraziť abstrakt
Modifikované mRNA vakcíny chránia pred infekciou vírusom Zika
Článok
ZobraziťZobraziť abstrakt
Článok
ZobraziťZobraziť abstrakt
Článok
ZobraziťZobraziť abstrakt
Ochrana proti vírusu Zika jedinou vakcináciou mRNA s nízkou dávkou nukleozidov
Článok
ZobraziťZobraziť abstrakt
kapitola
ZobraziťZobraziť abstrakt
Nanotechnológie v dodávaní mRNA terapeutík pomocou nevírusových vektorových dodávacích systémov
Článok
ZobraziťZobraziť abstrakt
Článok
ZobraziťZobraziť abstrakt
Európske regulačné prostredie vakcín na báze RNA
kapitola
ZobraziťZobraziť abstrakt
Technológia RNActive®: Generovanie a testovanie stabilných a imunogénnych mRNA vakcín
kapitola
ZobraziťZobraziť abstrakt
Dodávanie mRNA asistované lipidovými nanočasticami pre silnú imunoterapiu rakoviny
Článok
ZobraziťZobraziť abstrakt
Článok
Článok
ZobraziťZobraziť abstrakt
mRNA: Všestranná molekula pre vakcíny proti rakovine
Článok
ZobraziťZobraziť abstrakt
Článok
ZobraziťZobraziť abstrakt
Článok
ZobraziťZobraziť abstrakt
Článok
ZobraziťZobraziť abstrakt
Článok
Článok
K dispozícii plné znenie
ZobraziťZobraziť abstrakt
Článok
K dispozícii plné znenie
ViewShow abstract
From the RNA world to the clinic
Article
ViewShow abstract
Article
ViewShow abstract
Systemic RNA delivery to dendritic cells exploits antiviral defence for cancer immunotherapy
Article
View Show abstract
Nemôžete kopírovať obsah tejto stránky